Anamnese
Eine 80-jährige Patientin mit Rezidiv eines triplenegativen Mammakarzinoms unter Atezolizumab und Nab-Paclitaxel klagt über eine Kniegelenksschwellung und Weichteilschwellung sowie Bewegungseinschränkung an den Fingern.
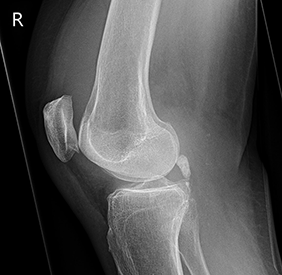
Röntgenbild rechtes Knie, seitlich; Gelenkerguss. Aufnahme Klinikum Fürth
Aktuelle Medikation
Antihypertensiva, L-Thyroxin, ASS 100
Seit drei Monaten zwei Zyklen Nab-Paclitaxel/Atezolizumab
Diagnose und Therapie
Verdacht auf Checkpoint-Inhibitor-induzierte inflammatorische Arthritis (IA) und milde Hepatitis unter Atezolizumab. Therapie der IA: Aktuell noch kein Steroid. Die Patientin erhält eine antiphlogistische Therapie mit Ibuprofen 400 mg 1-1-1-0, p.o. und Magenschutz mit Pantoprazol 40 mg 1-0-0-0, p.o. Abwarten einer klinischen Besserung der Gelenkbeschwerden unter Ibuprofen und dann Fortsetzung der Atezolizumab-Therapie unter Kontrolle der Leberwerte.
| Differentialdiagnosen zur CI-induzierten inflammatorischen Arthritis [5] | |
|---|---|
| Diagnose | Klinik |
| Osteoarthrose (OA) | harte, derbe, knöcherne Schwellungen |
| Infektiöse (septische) Arthritis oder Protheseninfektion | in der Regel monoartikulär mit Erregernachweis im Gelenkpunktat, Fieber, Leukozytose |
| Kristallarthropathie | Gicht/Pseudogicht, meist monoartikulär |
| "echte" Reaktive Arthritis | rezente Urethritis od. Enteritis in der Anamnese, meist als Mono- oder asymmetrische Oligoarthritis, HLA-B27-assoziiert |
| Virale Arthritiden (Röteln/Parvovirus B19/Hepatitis B, C; selten HTLV-I) | Arthritis bei Röteln oder bei Parvovirusinfektion hält meist einige Tage bis Wochen an; geht oft mit Fieber und Exanthem einher |
| Knochenmetastasen | auch erosive knöcherne Veränderungen möglich |
| Paraneoplastische Syndrome. z.B.: Hypertrophe Osteoarthropathie (Marie-Bamberger-Syndrom) | Trommelschlägelfinger, Uhrglasnägel, schmerzhafte Schwellungen der langen Röhrenknochen; PFPAS (palmare Fasziitis und Polyarthritis-Syndrom) |
| Sarkoidose | v.a. Sprung- oder Kniegelenke, Erythema nodosum, bihiläre Lymphadenopathie |
Pathomechanismus
PD-1 hemmt die Aktivierung und Proliferation von T-Zellen durch Bindung an PD-L1. Tumorzellen können PD-L1 auf ihrer Oberfläche exprimieren und sich so der Tumorabwehr entziehen (immune escape). Die Blockade dieses Immuncheckpoints durch Antikörper gegen PD-L1 (z.B. Atezolizumab) oder PD-1 (z.B. Nivolumab) führt zu einer verstärkten Aktivierung der T-Zellen, die sich gegen Tumorzellen richten soll, aber auch alle Arten von Autoimmunprozessen auslösen kann.
Checkpoint-Inhibitoren werden bei zunehmend mehr Tumorentitäten eingesetzt, damit steigt die Zahl der immunbedingten unerwünschten Ereignisse (irAE: immune-related adverse events). Die Immunhepatitis ist gut bekannt und therapielimitierend, aber auch therapieassoziierte Arthritiden sind möglich.
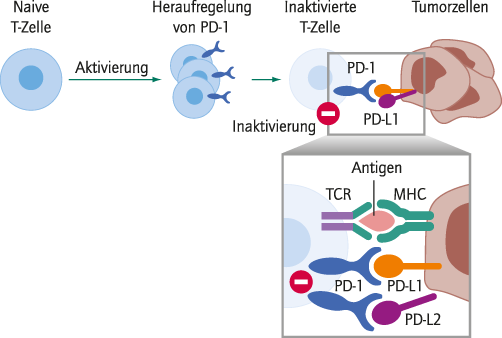
Abb. 1. PD-1 wird auf aktivierten T-Zellen während der Effektorphase hochreguliert. PD-L1 und PD-L2 auf Tumorzellen belegen den PD-1-Rezeptor auf T-Zellen und regeln dessen Aktivität herunter. Die Tumorzellen werden sozusagen als "eigen" toleriert. Es kommt zu Selbsttoleranz und damit zum sogenannten Tumor-Escape. MHC: Major histocompatibility complex; PD-1: Programmed Cell Death Protein; PD-L1: Ligand des Programmed Cell Death Protein; TCR: T-Zellrezeptor [2]
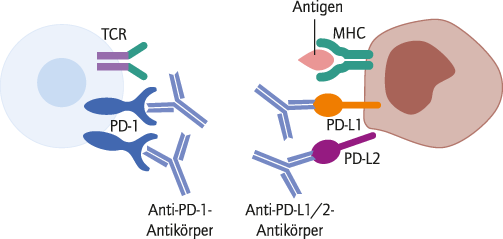
Abb. 2. Durch Bindung von Antikörpern an PD-1 oder deren Liganden kommt die in Abbildung 1 beschriebene Interaktion nicht zustande und die T-Zelle bleibt aktiv. Der Tumor-Escape wird unterbunden. MHC: Major histocompatibility complex; PD-1: Programmed Cell Death Protein; TCR: T-Zellrezeptor [2]
Wichtige Hinweise – Lessons learned
- Checkpoint-Inhibitoren (CI) können Autoimmunprozesse induzieren, die in etwa 20% schwer und lebensbedrohlich sind; bei Kombination verschiedener Checkpoint-Inhibitoren sogar in 59% der Fälle [4]. Häufige irAE sind Hautnebenwirkungen, Autoimmunhepatitis, Autoimmunkolitis und Endokrinopathien (Thyreoiditis, Hypophysitis, Adrenalitis, Diabetes mellitus). Die schwerwiegendste muskuloskelettale Nebenwirkung ist die Myositis mit der Gefahr einer Myokarditis, Respirationsversagen und Myasthenia gravis.
- Zu den häufigsten rheumatischen irAEs zählt die Checkpoint-Inhibitor-induzierte inflammatorische Arthritis (IA). Bei Patienten ohne Arthritis vor CI-Therapie, kann bei neu aufgetretener Arthritis unter CI-Therapie eine CI-induzierte IA angenommen werden. Leitsymptom der IA ist die schmerzhafte, weiche ("synovitische") Schwellung der betroffenen Gelenke [5].
- Die Therapie der IA erfolgt im Stufenschema mit NSAR, Glucocorticoiden, mit konventionellen synthetischen oder biologischen DMARDs (Disease modyfing antirheumatic drugs), z.B. Methotrexat, Sulfasalazin, Leflunomid oder Hydroxychloroquin (konventionell synthetisch); in schweren Fällen ggf. TNF-Inhibitoren oder Interleukin(IL)-6-Rezeptor-Inhibitoren (biologische DMARDs) [1].
- Es sollte in Absprache zwischen Rheumatologen, Onkologen und Patienten eine Therapie erfolgen, bei der die Immunsuppression hoch genug ist, um die Symptome der IA zu kontrollieren, aber niedrig genug, dass die antitumorale Immunantwort erhalten bleibt. Durch eine frühzeitige Diagnose und Therapie der IA kann die Therapie mit Checkpoint-Inhibitoren oft fortgesetzt werden [6].
Diesen Fall haben für Sie zusammengefasst
Dr. med. Anja Knüppel-Ruppert, Prof. Dr. med. Harald Dormann, Dr. rer. nat. Barbara Pfistermeister, Dr. med. Stefan Kallert

Quellen
- Grümme L, Schulze-Koops H. Checkpoint-Inhibitoren in der Onkologie: Rheumatologische Symptome beherrschen. Dtsch Arztebl 2022; 119(7): [18]; DOI: 10.3238/PersOnko.2022.02.18.03
- Barth J. Immunagonistische Antikörper – Pharmakologie und Management von irAEs. Krankenhauspharmazie 2016;37:333–44
- Fachinformation Tecentriq
- Heinzerling L, de Toni E, Schett G, Hundorfean G, Zimmer L. Checkpoint inhibitors - the diagnosis and treatment of side effects. Dtsch Arztebl Int 2019;116:119–26. DOI: 10.3238/arztebl.2019.0119
- Kastrati K, Bonelli M. Diagnose und Management der Immun-Checkpoint-Inhibitor-induzierten inflammatorischen Arthritis. SPIO Spectrum ImunOnkologie
- Kostine M, et. al. EULAR points to consider for the diagnosis and management of rheumatic immune-related adverse events due to cancer immunotherapy with checkpoint inhibitors. Ann Rheum Dis. 2021;80:36–48. https://ard.bmj.com/content/80/1/36
- Chatzidionysiou K, et. al. Behandlung rheumatischer immunbedingter Nebenwirkungen bei der Krebsimmuntherapie mit Immun-Checkpoint-Inhibitoren – ist es Zeit für einen Paradigmenwechsel? Kompass Autoimmun 2022;4:2–9. https://doi.org/10.1159/000521939
Kontakt
Klinikum Fürth
Studienzentrale der Zentralen Notaufnahme
Jakob-Henle-Straße 1
90766 Fürth
Falls Sie Fragen zu den Nebenwirkungen des Monats haben, schreiben Sie uns eine E-Mail an: zna-studienzentrale@klinikum-fuerth.de
