Tilman Schöning, Heidelberg
Die Weltgesundheitsorganisation (WHO) definiert Gen-Therapie als „die Einbringung von genetischem Material in ein Individuum oder die Veränderung des genetischen Materials eines Individuums mit dem Ziel eines therapeutischen Effektes“ [1]. Nach der Definition der Deutschen Forschungsgemeinschaft bezeichnet Gen-Therapie „das Einbringen von Genen in Gewebe oder Zellen mit dem Ziel, durch die Expression und Funktion dieser Gene therapeutischen oder präventiven Nutzen zu erlangen“. Den Vorgang des Einbringens von Genen in Zellen nennt man Gen-Transfer. Hierfür benötigt man ein Vehikel, das das Gen trägt, einen sogenannten Vektor [2]. Dieser Vektor kann ein Virus, ein bakterielles Plasmid oder irgendein anderer Organismus sein, der in dem entsprechenden Wirtsorganismus nicht natürlicherweise vorkommt, aber nach Aufnahme in diesen in der Lage ist, sich auszubreiten. Hierdurch wird genetisches Material in einer Weise verändert, die nicht natürlich induziert ist, zum Beispiel durch Paarung oder natürliche Rekombination [3].
Wird nachfolgend der Term „Gen-Therapeutika“ verwendet, so ist er durch oben aufgeführte Definitionen charakterisiert unter der Voraussetzung des Einsatzes einer zugelassenen Therapieoption.
Mittlerweile existiert eine bemerkenswerte Auswahl an Gen-therapeutischen Ansätzen für unterschiedliche medizinische Indikationen. Unterschiedliche Arten von Vektoren werden verwendet, wenngleich vorwiegend Viren als Vektoren eingesetzt werden [4]. Aufgrund der Eigenschaften von Viren als Vektoren, die in Gen-Therapeutika eingesetzt werden, sind im klinischen Umfeld verschiedene Gesichtspunkte im Umgang mit diesen Arzneimitteln von Bedeutung. Dabei sind die notwendigen Abläufe durchaus vergleichbar mit dem Handling von zytotoxischen Substanzen oder infektionsgefährdendem Material. So sind, neben weiteren Anforderungen, die zu treffenden Schutzmaßnahmen, wie die persönliche Schutzausrüstung, aber auch die technische Ausrüstung am Arbeitsplatz zu nennen.
Die Entwicklung der hier präsentierten Leitlinie zum Umgang mit Gen-Therapeutika in europäischen Apotheken wurde durch eine Lenkungskommission von Vertretern der EAHP aus verschiedenen europäischen Ländern geleitet. Alle 10 Vertreter wurden als pharmazeutische Spezialisten im Bereich Gen-Therapeutika ausgewählt. Zur Sicherstellung der Qualität der Leitlinie wurden die Kriterien nach [4] befolgt. Europäische Vorschriften mit Bezug zur Problematik wurden bei der Entwicklung berücksichtigt [5, 6], ebenso wie weitere Empfehlungen und Leitlinien aus dem angelsächsischen Bereich [7–9]. Für umfassendere Informationen zum Entwicklungsprozess und den weiteren Zusammenhängen wird auf die Originalpublikation verwiesen [10].
Die Leitlinie soll auf europäischer Ebene weitgehende, praktische Empfehlungen im Umgang mit zugelassenen Gen-Therapeutika geben. Enthalten sind Empfehlungen für alle Schritte im klinischen Bereich, wie Lagerung, Transport, Zubereitung, Abgabe, Verabreichung, Entsorgung, Dekontamination und unbeabsichtigte Freisetzung.
Umgang mit Gen-Therapeutika und Probenmaterial in der Patientenversorgung
Diese in Tabelle 1 wiedergegebenen Empfehlungen fokussieren sich auf die minimalen Voraussetzungen im Umgang mit Gen-Therapeutika und Probenmaterial von behandelten Patienten. Da Variationen abhängig vom Staat oder der Region möglich sind, sollten allerdings die regionalen Vorschriften nicht außer Acht gelassen werden.
Tab. 1. Allgemeine Leitlinie zum Umgang mit Gen-Therapeutika und Probenmaterial behandelter Patienten Folgende allgemeine Maßnahmen müssen befolgt werden beim Umgang mit Gen-Therapeutika, Probenmaterial behandelter Patienten (Patientenblut, Gewebe, Körperflüssigkeiten) sowie kontaminiertem Material nach Behandlung
|
Maßnahmen |
Weitere Hinweise, Informationen |
|
Tragen geeigneter Schutzkleidung, um das Risiko für eine mikrobiologische Kontamination mit dem therapeutischen Agens während der Zubereitung zu minimieren. Die Qualität dieser Kleidung muss ebenso geeignet sein, um das therapeutische Agens vor Kontamination zu schützen. Einmalwäsche ist zu bevorzugen, außer es gibt verlässliche Evidenz, dass der Vektor nicht verbreitet werden kann. |
Optimalerweise Einmal-Schutzkittel, Schutzbrille, Handschuhe, Schleimhaut-Spritzschutz |
|
Arbeit an einer biologischen Sicherheitswerkbank oder einem für den pharmazeutischen Einsatz geeigneten Isolator (kompatibel mit EN 12469:2000) – Minimum Klasse II, Typ B |
Siehe Abbildung 2 |
|
Nadeln und Kanülen: Adäquate Vorsichtsmaßnahmen für Umgang und Entsorgung sind zu definieren |
Siehe Abbildung 5 |
|
Sicherstellung der Dekontamination von Arbeitsflächen |
Siehe Abbildung 2 |
|
Reinigung und Dekontamination von Patientenbettwäsche muss angelehnt an das Vorgehen bei mit Blut und Körperflüssigkeiten beschmutzten Textilien erfolgen |
Siehe Abbildung 5 Isolationsbereiche nicht erforderlich |
|
Keine besonderen Vorsichtsmaßnahmen für Stuhl- und Urin-Ausscheidungen über Kanalisation; spezielle Angaben in der Produktinformation des entsprechenden Präparats sind gegebenenfalls jedoch zu berücksichtigen |
Patienten sollten die normalen sanitären Einrichtungen benutzen, falls nicht anders angegeben. |
|
Transport und Lagerung von Patientenproben müssen in verschlossenen, beschrifteten, auslaufsicheren Behältnissen erfolgen |
Siehe Tabelle 2 |
|
Verwurf von Produkt, kontaminiertem Müll und Patientenproben müssen den lokalen Entsorgungsvorgaben der Einrichtung entsprechen |
Materialien, die außerhalb des unmittelbaren Arbeitsbereichs vernichtet werden, müssen in einem stabilen, flüssigkeitsdichten und verschlossenen Behältnis zur Abholung bereitgestellt werden. Siehe Abbildung 5 |
Lagerung von Gen-Therapeutika
Abbildung 1 zeigt Handlungsweisen für die Lagerung von Gen-Therapeutika. Bei Entnahme aus der Lieferverpackung sollte immer Schutzkleidung getragen werden aufgrund des Risikos der Beschädigung der Verpackung während des Transports. Die Primärverpackung darf nur unter einer Biosicherheitsvorrichtung (Sicherheitswerkbank oder Isolator) geöffnet werden.
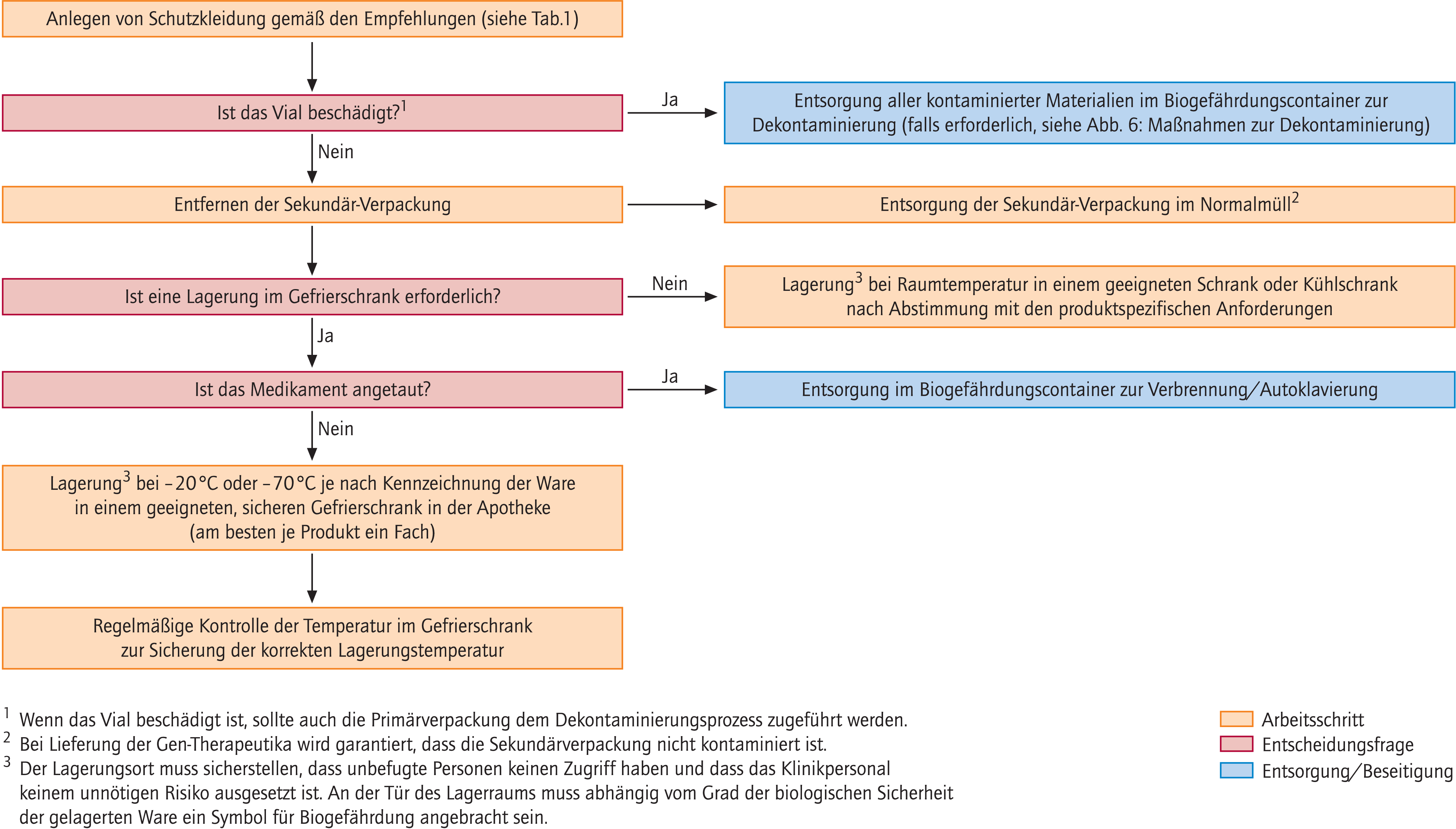
Abb. 1. Lagerung von Gen-Therapeutika
Bei Beschädigungen der Primärverpackung (Ampulle/Flasche) muss eine Entsorgung aller kontaminierten Materialien im Abfallcontainer für biogefährdende Materialien stattfinden. Die Gen-Therapeutika sollten gemäß den Vorgaben für das Temperaturintervall in einem sicheren Bereich innerhalb der Apotheke gelagert werden. Jedem Gen-Therapeutikum sollte ein getrennter Lagerplatz zugewiesen werden. Ein Temperaturmonitoring und eine Einschränkung der Zugriffsberechtigten sollten gewährleistet sein. Dies gilt im Besonderen dann, wenn die Lagerung außerhalb der Apotheke stattfindet. Sollten dann andere Personen mit dem Umgang betraut werden, müssen diese vorher adäquat geschult werden, indem alle notwendigen Handlungsanweisungen gegeben werden, zum Beispiel im Fall eines Ausfalls der Tiefkühltruhe.
Zubereitung von Gen-Therapeutika
Die Zubereitung von Gen-Therapeutika sollte aufgrund der Gefahr einer Freisetzung von Aerosolen in geeigneten Biosicherheitsvorrichtungen stattfinden (Abb. 2). Dies ist entweder ein für pharmazeutische Zwecke geeigneter Isolator oder aber eine biologische Sicherheitswerkbank (Minimum Klasse II, Typ B, die mit den Kriterien der Centers for Disease Control [CDC] [11] und den aktuellen europäischen Standards [EN12469:2000] kompatibel sind). Diese dürfen nicht im Umluftverfahren betrieben werden, damit eine Abgabe der potenziell kontaminierten Luft in den Raum vermieden wird. Eine zentrale Forderung, die an das Arbeitsgerät zu stellen ist, ist die Vermeidung von Cross-Kontaminationen.
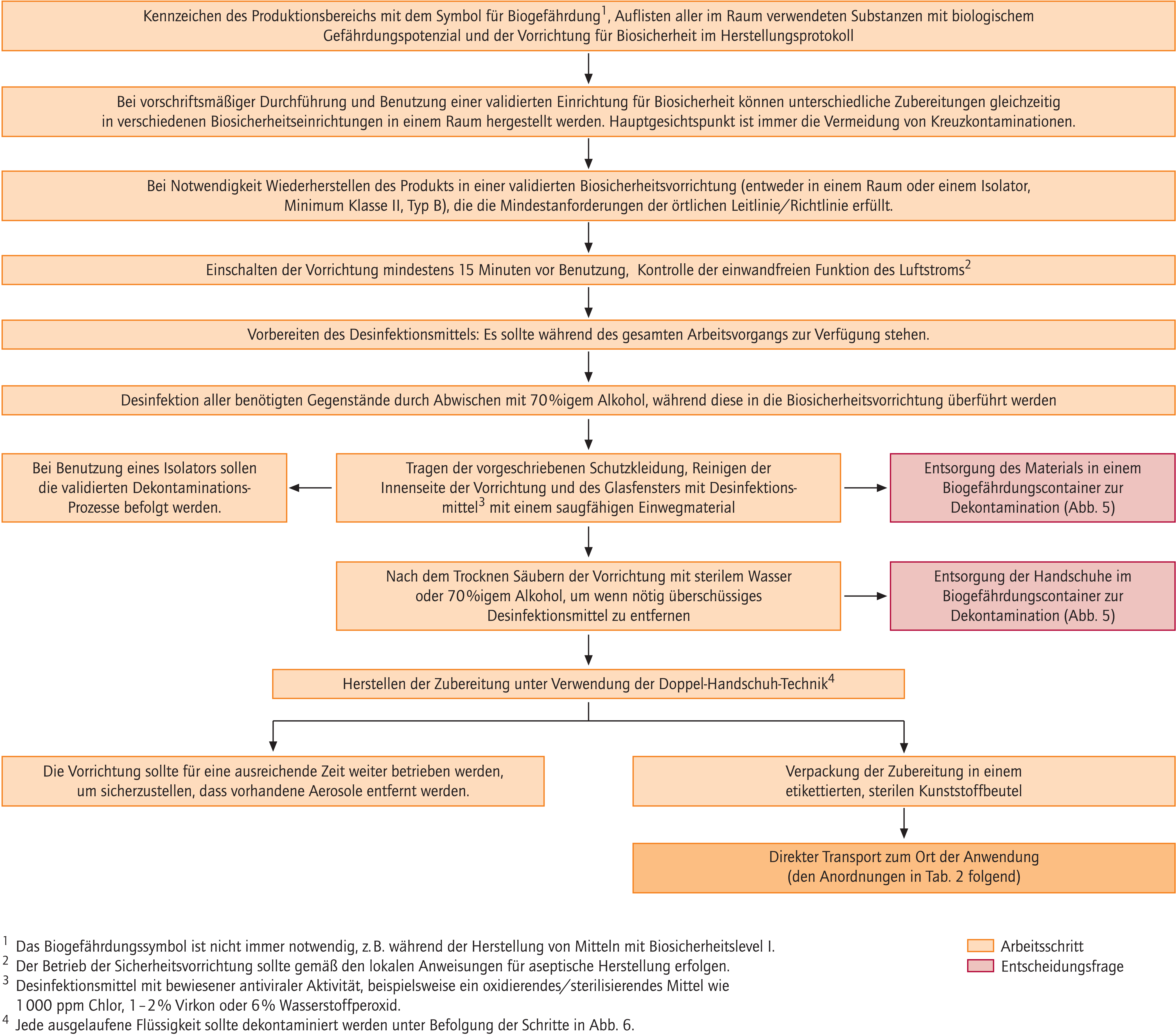
Abb. 2. Zubereitung von Gen-Therapeutika und Dekontamination der für die Herstellung verwendeten Biosicherheits-Einrichtungen
Negativer Druck des Herstellungsbereichs gegenüber den Außenbereichen muss nicht gewährleistet werden, soweit die Risikobewertung eines Gen-Therapeutikums dies nicht ausdrücklich empfiehlt.
Es ist keine Bedingung, wird aber empfohlen, dass während der Zubereitung und in einem definierten Zeitfenster vor und nach der Herstellung des Gen-Therapeutikums keine andere Werkbank in diesem Raum betrieben wird.
Ein geeignetes Desinfektionsmittel sollte während des gesamten Zubereitungsprozesses, der das Gen-Therapeutikum betrifft, vorhanden sein. Insbesondere für den Fall der Freisetzung durch Bruch, Auslaufen oder ähnliche unvorhergesehene Vorgänge ist Vorsorge zu treffen. In diesem Zusammenhang muss darauf hingewiesen werden, dass solide Daten zur Tauglichkeit der eingesetzten Desinfektionsmittel im entsprechenden Einsatzbereich vorhanden sein müssen. Da zum Zeitpunkt der Erarbeitung dieser Leitlinie keine publizierten Daten verfügbar waren, gilt die Empfehlung der Arbeitsgruppe der EAHP. Sie empfiehlt die Verwendung von Chlor 1000 ppm, Virkon® 1–2% oder Wasserstoffperoxid 6% als mögliche Optionen. Spezielle Empfehlungen zu den verwendeten Gen-Therapeutika (Produktempfehlungen/Fachinformationen) müssen beachtet werden.
Das verwendete Herstellungsgerät sollte nach Abschluss der Arbeiten für eine Zeit zwischen 15 Minuten und einer Stunde weiterbetrieben werden, um einen Verbleib von Aerosolen auszuschließen. Eine Oberflächendekontamination muss aber in jedem Fall in sorgfältiger Weise erfolgen.
Die erwähnten Vorgaben lassen sich am besten bewältigen, wenn alle Zubereitungsprozesse im Vorfeld adäquat geplant und zeitlich koordiniert werden.
Ziel sollte sein, dass das Produkt unmittelbar nach Zubereitung direkt zum Anwender transportiert werden kann.
Transport von Gen-Therapeutika
Innerhalb der klinischen Einrichtung sollte der Transport von Gen-Therapeutika nach festgelegten Abläufen stattfinden (Tab. 2). Der Transport sollte möglichst zeitnah nach Abschluss des Zubereitungsprozesses erfolgen. Ein auslaufsicherer, gekennzeichneter Behälter für biogefährdendes Material ist zu verwenden. Das zubereitete Gen-Therapeutikum sollte in einer Plastikfolie oder einem anderen geeigneten Sekundärpackmittel eingeschweißt sein. Die Transportbedingungen haben den individuellen Vorgaben des Produkts Rechnung zu tragen (z.B. Temperaturüberwachung). Ein Dekontaminations-Set muss während des Transports immer verfügbar sein. Im optimalen Fall wird die Zubereitung nach Lieferung nicht mehr gelagert, sondern sofort verabreicht.
Tab. 2. Transport von Gen-Therapeutika
|
Transport Zubereitete Gen-Therapeutika sollten innerhalb der klinischen Einrichtung in einem auslaufsicheren, gekennzeichneten Behälter für biogefährdendes Material transportiert werden. Das zubereitete Gen-Therapeutikum sollte in einer Plastikfolie oder einem anderen geeigneten Sekundärpackmittel eingeschweißt sein. Die Transportbedingungen haben den individuellen Vorgaben des Produkts Rechnung zu tragen (z.B. Temperaturüberwachung). |
|
|
Dekontaminations-Set (Spill Kit) Ein Dekontaminations-Set muss während des Transports immer verfügbar sein. Alternativ kann auch an mehreren Stellen des Transportwegs ein Dekontaminations-Set vorhanden sein (siehe Abbildung 6 für weitere Details) |
|
|
Minimalausrüstung eines Dekontaminations-Sets 2 x Flüssigkeitsabweisende Armstulpen 4 x Handschuhe 2 x Atemschutzmaske 2 x Flüssigkeitsabweisender Einmalschutzkittel 2 x Schutzbrille 4 x Überschuhe |
Saugfähige Tücher 2 x Einmalzange 2 x Abwurfbehälter für biogefährdendes Material Notfall-Telefonnummer Kopie der Handlungsanweisung für den Fall der Freisetzung von Gen-Therapeutikum |
|
Verabreichung Im optimalen Fall wird die Zubereitung nach Lieferung nicht mehr gelagert, sondern sofort verabreicht. Lagerung in der Therapieeinheit sollte vermieden werden, um die Zahl der dem Gen-Therapeutikum ausgesetzten Orte zu minimieren. Stabilitätsdaten für das individuelle Präparat sind zu beachten. |
|
|
Nach Eintauchen in Desinfektionsmittel und Dekontamination kann ein auslaufsicherer Transportbehälter wiederverwendet werden |
|
Abgabe von Gen-Therapeutika
Allgemeine Hinweise zur Abgabe von Gen-Therapeutika werden in Abbildung 3 gegeben.
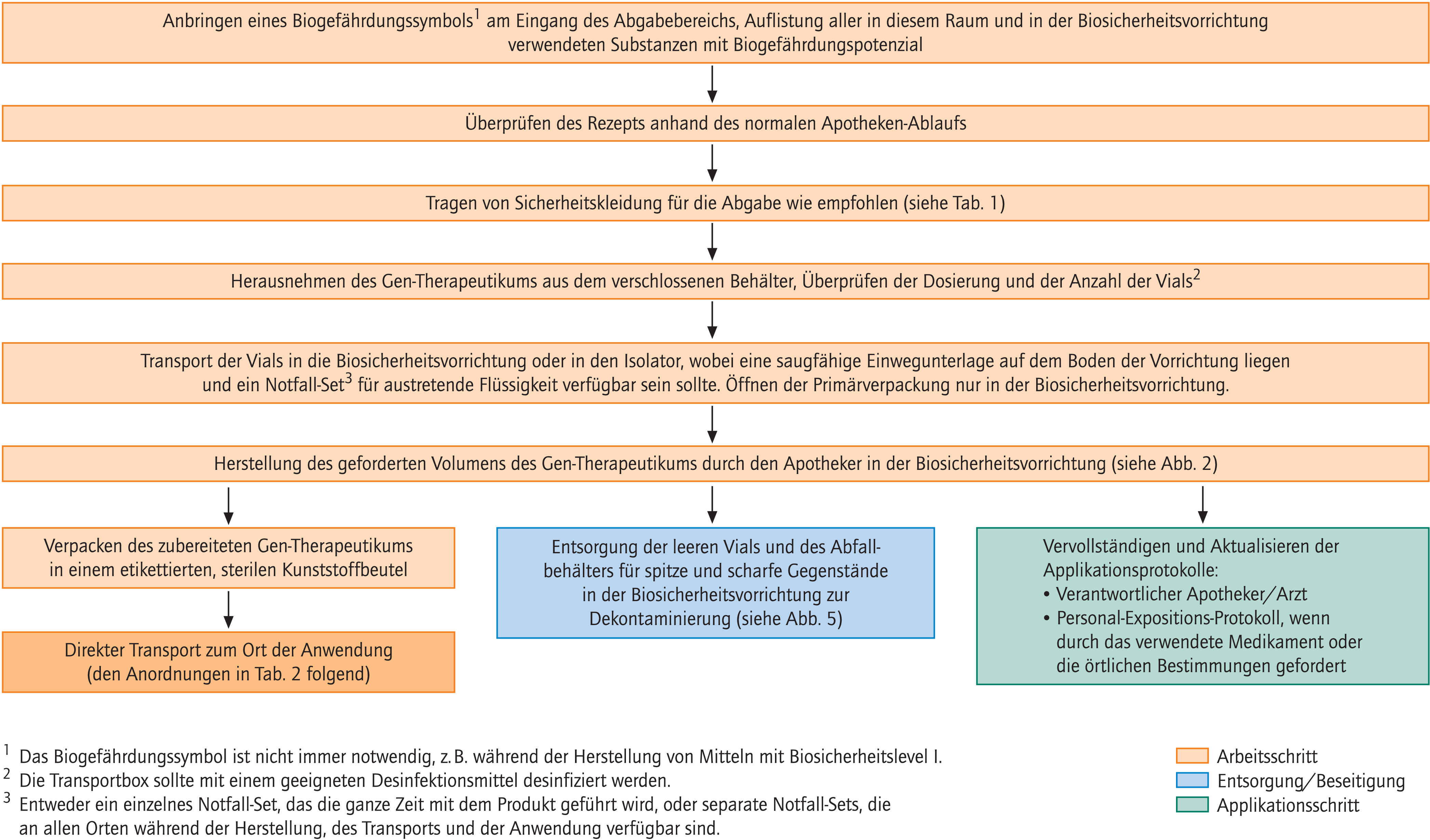
Abb. 3. Abgabe-Vorgang für Gen-Therapeutika
Eine Reihe von wichtigen administrativen Aufgaben kann mit der Abgabe von Gen-Therapeutika verbunden sein:Protokollführung kann eine Möglichkeit darstellen, die einzelnen Schritte im Umgang mit Gen-Therapeutika aufzuzeichnen, wenn dies erforderlich ist. Ebenso kann eine Buchführung über die Mitarbeiter, die an der Prozesskette im Umgang mit Gen-Therapeutika beteiligt sind, sinnvoll sein. Allgemeine Vorgaben zur Gesundheitsüberwachung existieren nicht, wenn auch für Gen-Therapeutika, die die Biosicherheitsstufe 2 oder höher besitzen, Vorschriften vorhanden sein können, beispielsweise der britischen Health and Safety Executive (Control of substances hazardous to health, COSHH) [12].
Verabreichung von Gen-Therapeutika
Abbildung 4 skizziert einige weit gefasste Hinweise hinsichtlich der Verabreichung von Gen-Therapeutika, die von klinischem Personal zur Erstellung eigener SOPs genutzt werden können.
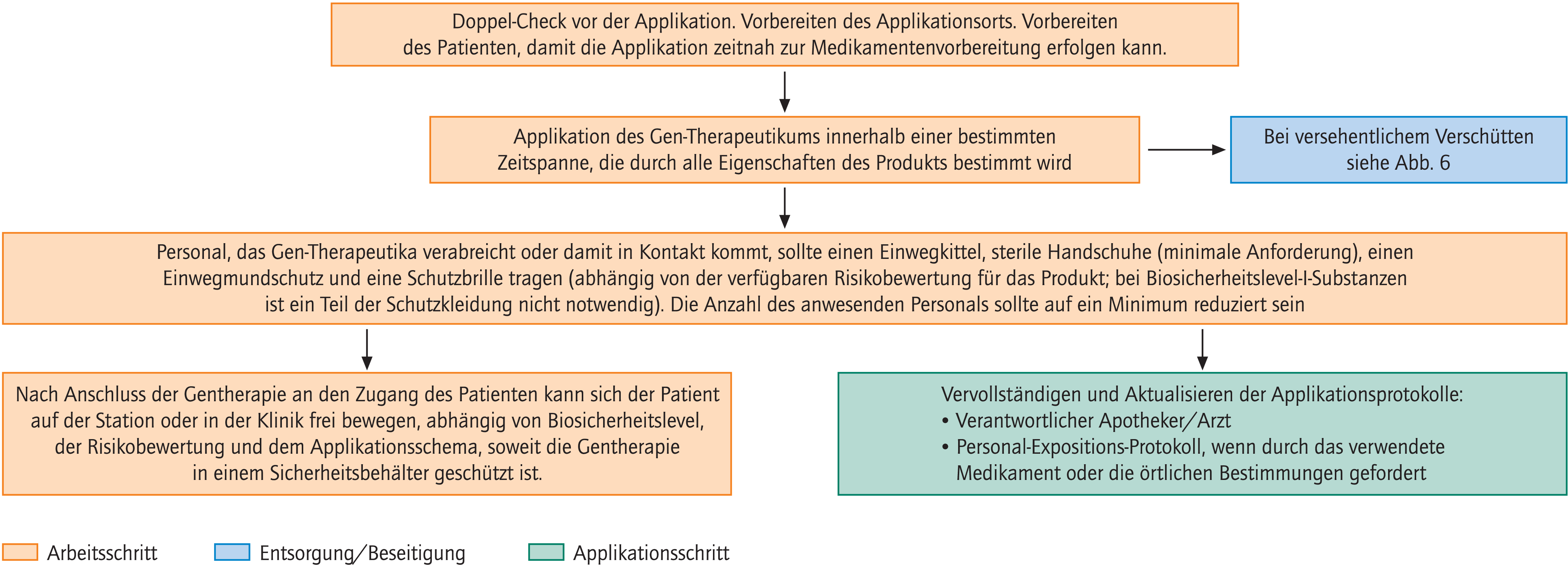
Abb. 4. Anleitung für klinisches Personal zur Entwicklung von SOPs
Zeitliche und organisatorische Koordination zwischen den Teams der unterschiedlichen Bereiche ist eine Kernaufgabe. Ziel sollte dabei sein, dass Zubereitung, Transport und Verabreichung idealerweise einen in sich geschlossenen Prozess darstellen.
Entsorgung von Gen-therapeutischen Abfällen
Das Vorgehen bei der Entsorgung von gentherapeutischen Abfällen ist Abbildung 5 zu entnehmen.
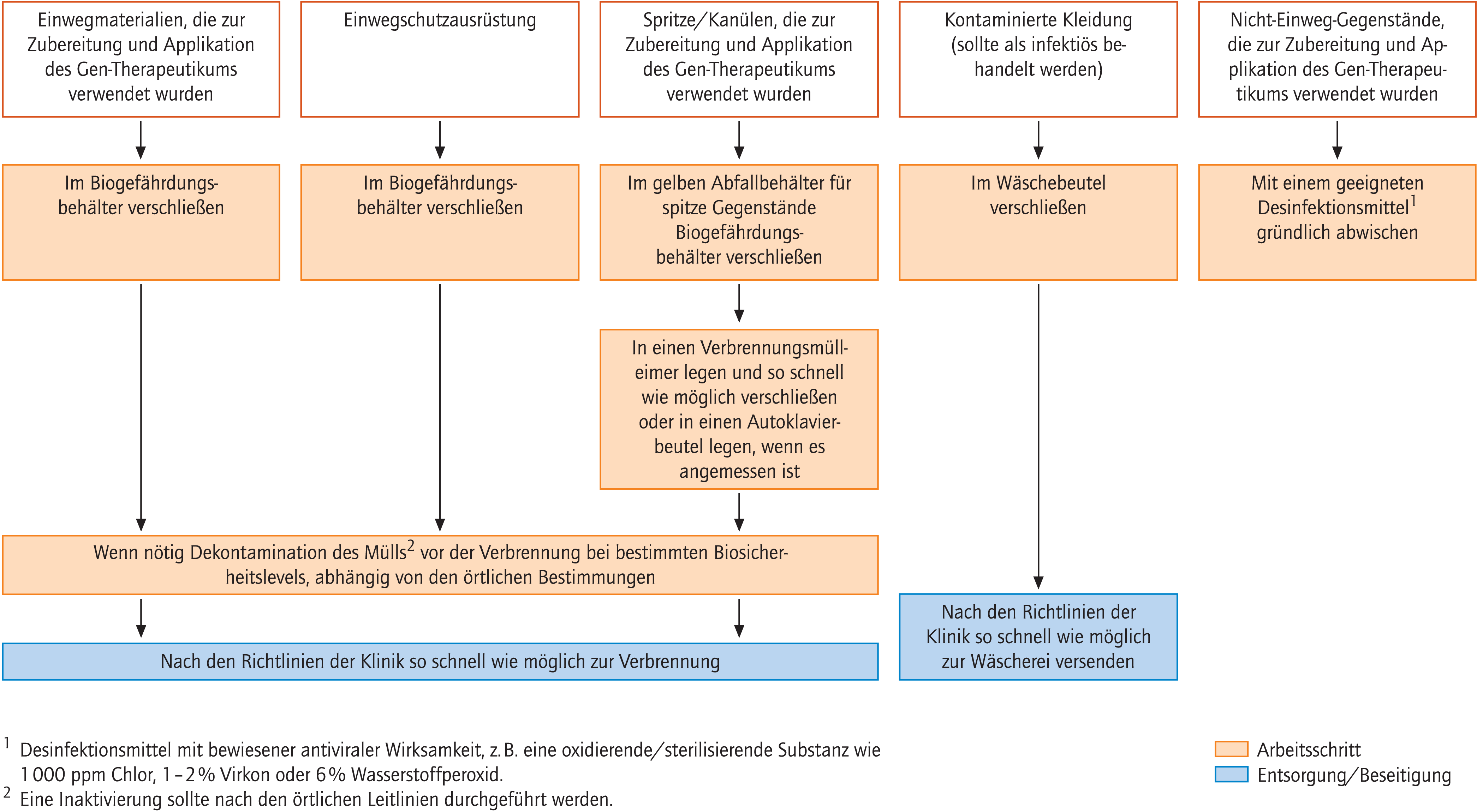
Abb. 5. Entsorgung von Gen-therapeutischen Abfällen
Den zentralen Punkt in der Entsorgung stellt die Vorgabe dar, jeglichem Kontakt des Gen-therapeutischen Materials mit Personen sowie mit der Umwelt vorzubeugen. Die Entsorgung aller Gen-therapeutischen Abfälle hat so zügig wie möglich zu erfolgen. Dabei sind Regelungen und Gesetzgebung auf lokaler Ebene hinsichtlich Lagerung, Abholung und Transport zu berücksichtigen.
Dekontamination nach Freisetzung von Gen-Therapeutika
Abbildung 6 zeigt die notwendigen Bestandteile für ein Dekontaminations-Set in Zusammenhang mit der unbeabsichtigten Freisetzung von Gen-therapeutischem Material und enthält Empfehlungen zur Dekontamination. Das Spill-Kit sollte in allen beschriebenen Arbeitsschritten verfügbar sein. Das Vorgehen der Dekontamination unterscheidet sich hinsichtlich der Freisetzung innerhalb oder außerhalb der Biosicherheitseinrichtung. Dabei ist in der Regel die Person, die die Freisetzung verursacht hat, auch verantwortlich für die Einleitung der Dekontaminationsmaßnahmen. Ein geeignetes Training für Dekontaminationsmaßnahmen sollten alle Personen erhalten, die am Umgang mit Gen-Therapeutika beteiligt sind. Letztlich ist der Apotheker für die Sicherstellung einer korrekten Beseitigung des freigesetzten Materials verantwortlich.
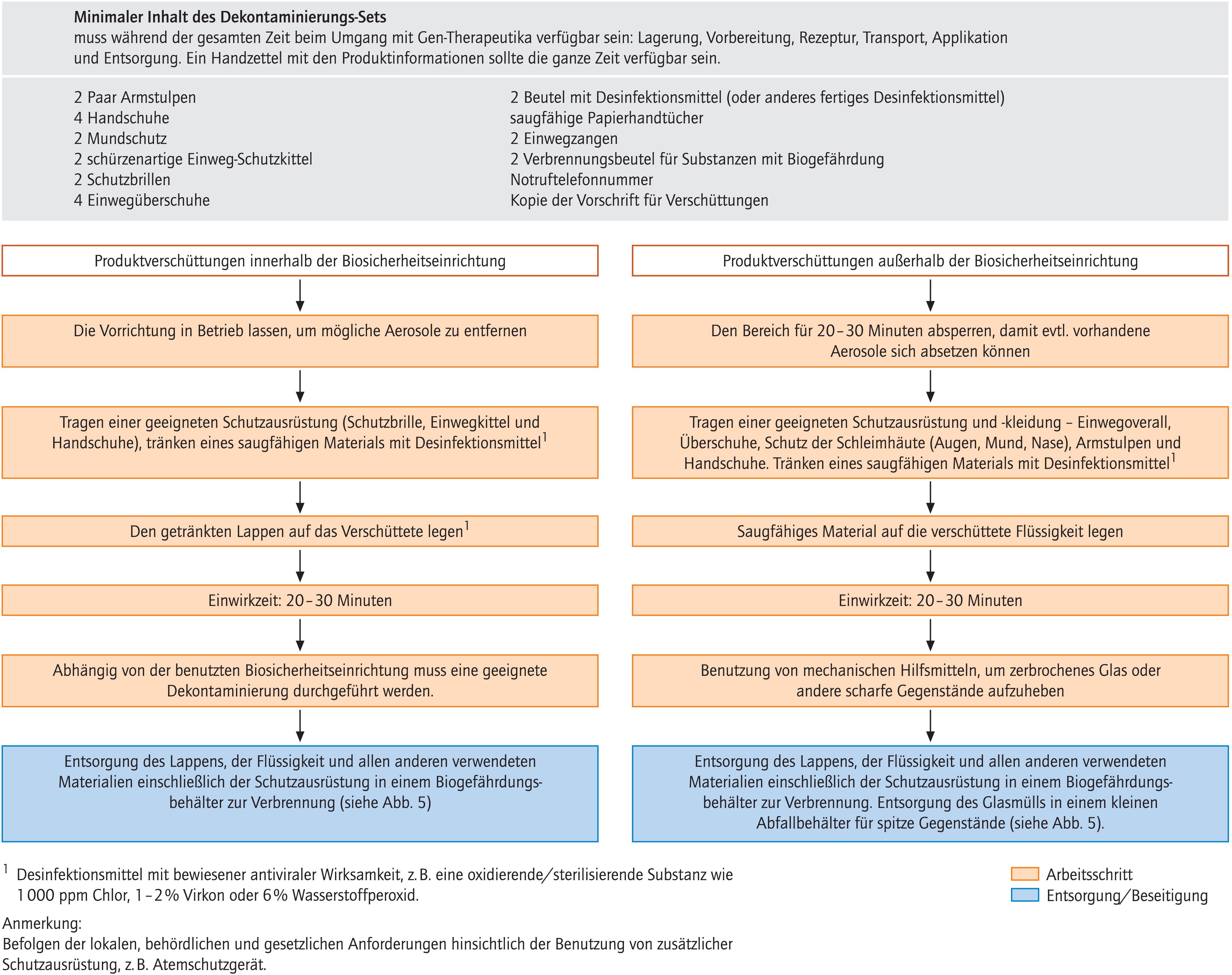
Abb. 6. Dekontamination von verschütteten Gen-Therapeutika
Unbeabsichtigte Exposition mit Gen-Therapeutika
Maßnahmen infolge unbeabsichtigter Exposition von Personen mit Gen-Therapeutika sollen gemäß den Vorgaben in Abbildung 7 erfolgen. Eine ärztliche Konsultation muss in allen Fällen stattfinden. Alle Hersteller sollten in den Fachinformationen, sowie den Beipackzetteln ihrer Produkte über Maßnahmen hinsichtlich des Vorgehens nach unbeabsichtigter Exposition informieren. Diese Informationsquellen müssen für alle Personen, die Umgang mit Gen-Therapeutika haben, jederzeit schnell verfügbar sein. Alle Vorfälle dieser Art sollten dokumentiert werden nach den individuellen Vorgaben der Einrichtung. Verantwortliche Personen müssen über die Gen-Therapeutika, die in der Einrichtung eingesetzt werden, sowie deren Risikopotenzial und Nebenwirkungen informiert sein. Lokale Vorschriften hinsichtlich der Unfallmeldung bei verschiedenen Einrichtungen sind zu berücksichtigen.
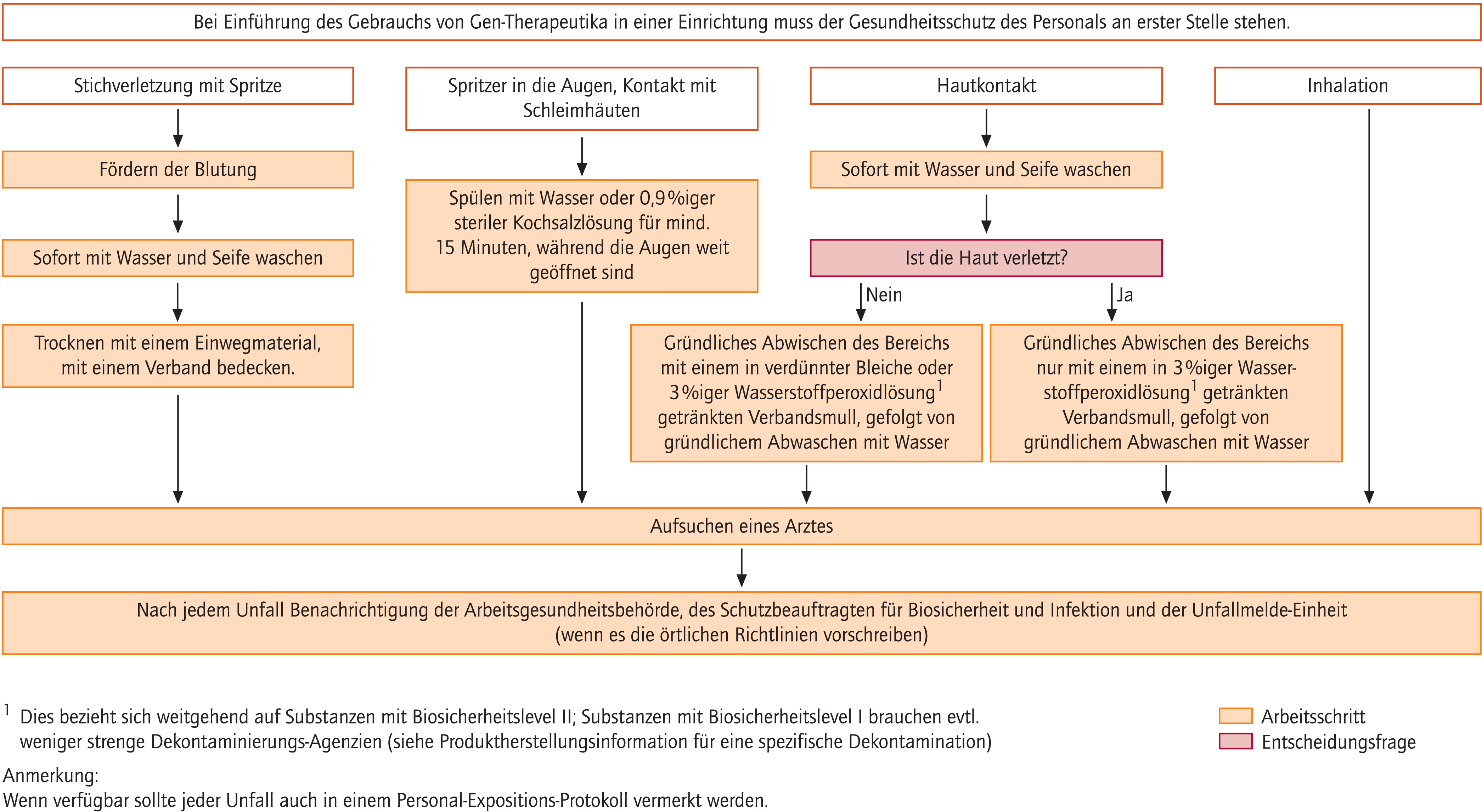
Abb. 7. Unbeabsichtigte Exposition mit Gen-Therapeutika
Zusammenfassung
Einheitliche Standards im Umgang mit Gen-therapeutischen Arzneimitteln sind mit zunehmender Entwicklung sowie verstärktem Einsatz dieser Präparate notwendig geworden. Die Erfahrungen, die Pharmazeuten im Handling von Arzneistoffen mit Gefahrenpotenzial über viele Jahre erworben haben, bilden die Grundlage für einen adäquaten, sicheren Umgang während Annahme, Lagerung, Ausgabe, Herstellung und Transport von Gen-Therapeutika. Die vorliegende Leitlinie definiert die minimalen Anforderungen, die in jeder Krankenhausapotheke im Umgang mit Gen-Therapeutika befolgt werden müssen.Dabei ist zu beachten, dass eine allgemeine Leitlinie nie alle Eventualitäten berücksichtigen kann. Daraus ergibt sich die Notwendigkeit, die nationalen und lokalen Gesetzgebungen hinsichtlich Gen-therapeutischer Regelungen regelmäßig zu sichten und bei der individuellen Umsetzung der Leitlinien vor Ort einzubeziehen. Auch den individuellen Vorgaben hinsichtlich der einzelnen Produkte, die in Beipackzettel oder Fachinformation zu finden sind, ist Rechnung zu tragen, um einen korrekten Umgang mit den jeweiligen Arzneimitteln zu gewährleisten.
Eine Orientierung an der vorliegenden Leitlinie gewährleistet nach heutigem Stand den bestmöglichen Standard hinsichtlich eines sicheren, qualitätsgerechten Umgangs mit Gen-therapeutischen Arzneimitteln im klinisch- pharmazeutischen Umfeld.
Mit dem Zuwachs an Erfahrung, der mit dem zunehmenden Einsatz dieser Arzneimittel verbunden sein wird, sind auch zukünftige Aktualisierungen dieser Leitlinie zu erwarten.
Literatur
1. Advisory Committee on Health Research. Genomics and World Health: Report of the Advisory Committee on Health Research. Geneva: World Health Organisation; 2002
2. Deutsche Forschungsgemeinschaft. Entwicklung der Gentherapie: Stellungnahme der Senatskommission für Grundsatzfragen der Genforschung. Mitteilung 5; 1. Auflage, Wiley VCH: Weinheim, 2007.
3. SACGM. The SACGM Comependium of guidance. Part 1: Introduction of the legislation and general health and safety issues. (20. August 2008); auf: www.hse.gov.uk/biosafety/bmo/acgm/acgmcomp/part2.pdf
4. Roth RI, Fleischer NM. Gene therapy: applications to pharmacy practice. J Am Pharm Assoc (Wash), 2002;42:692,4–8.
5. Council Directive 98/81/EC of 26 October 1998 amending Directive 90/219/EEC on the contained use of genetically modified micro-organisms. 98/81/EC;1998
6. Directive 2000/54/EC of the European Parliament and of the Council of 18 September 2000 on the protection of workers from risks related to exposure to biological agents at work (seventh individual directive within the meaning of article 16(1) of Directive 89/391/EEC). 2000/54/EC; 2000
7. Stoner NS, Gibson RN, Edwards J. Development of procedures to address health and safety issues in the administration of gene therapy within the clinical setting. J Oncol Pharm Prac 2003;9:29–35.
8. SACGM. The SACGM Compendium of guidance. Part 6: Guidance on the use of genetically modified microorganisms in a clinical setting. (5.April 2007); auf: www.hse.gov.uk/biosafety/gmo/acgm/acgmcomp/part6.pdf
9. DeCederfelt HJ, Grimes GJ, Green L, DeCederfelt RO, Daniels CE. Handling of gene-transfer products by the National Institutes of Health Clinical Center pharmacy department. Am J Health Syst Pharm 1997;54:1604–10.
10. Vulto AG, Stoner N, Balasova H, Cercos AC, Hoppe-Tichy T, Vinent-Genestar JL, Kontra K, Nydert P, Vermes A, Wolfsberger A. European Association of Hospital Pharmacists (EAHP) Guidance on the Pharmacy Handling of Gene Medicines.Eur J Hosp Pharm 2007;13:29–39.
11. U.S. Department of Health and Human Services Public Health Service CfDCaP, National Institutes of Health. Primary containment for biohazards: selection, installation and use of biological Ssfety cabinets. Washington, DC: U.S. Government Printing Office; 1995.
12. Health and Safety Executive. Control of substances hazardous to health (COSHH). (20.August 2008); auf: www.hse.gov.uk/coshh/index.htm
Tilman Schöning, Pharmazeutisch-Onkologisches Zentrum, Universitätsklinikum Heidelberg, Apotheke, Im Neuenheimer Feld 670, 69120 Heidelberg, E-Mail: Tilman.Schoening@med.uni-heidelberg.de
Guideline for safe handling of gene medicines in the pharmacy
What seems to be a vision of the future is already present today. Biotechnological innovation brings the treatment of hereditary and tumor diseases with gene medicines into reality. Whereas in Europe only used in the setting of clinical trials, licenced gene medicines are already used therapeutically in China and the US.
This leads to new challenges for hospital pharmacists, who are responsible for patient-individual preparation of gene medicines. Particularly of importance are the risks associated with handling of active viruses, which are capable of integration in human cells. Nevertheless, safe handling of gene medicines is possible. Based on risk assessments some important tasks should be performed: Training of staff, development of necessary SOPs and establishment of guidelines for prevention of cross contamination with other drugs. The presented guideline developed by the European Association of Hospital Pharmacists (EAHP) is an important tool for German hospital pharmacists to ensure safe handling of gene medicines.
Keywords: Gene-therapy, adenovirus, safe handling, precaution, standard operating procedures (SOPs) EAHP-guideline, pharmacy
Krankenhauspharmazie 2009; 30(02)
