Dr. Tilman Schöning, Dr. Le Hang Pelzl Heidelberg
Es handelt sich in der Regel um nicht- oder nur gering humanpathogene Viren. Die lytische Wirkung der Viren ist tumorspezifisch. Durch die Aktivierung von RAS oder Bestandteilen des RAS-Signaltransduktionswegs in entsprechenden Tumorgeweben wird die Aktivierung einer Proteinkinase vermindert, die frühe Virus-RNA unter normalen Umständen zu spalten vermag. Somit kommt es zu einer Infektion der Tumorzelle und im Folgenden zur Zelllyse. Bei dem beschriebenen Therapieprinzip handelt es sich jedoch nicht um Gentherapeutika. Nach der Definition von Gentherapeutika stellt der eingesetzte Organismus (z.B. Virus) den Vektor für einzubringendes Genmaterial dar. Aufgrund dieser Tatsache und der Anwendung am Menschen unterliegen die in der Apotheke ausgeführten Tätigkeiten nicht dem Gentechnikgesetz (GenTG), aber der Verordnung über Sicherheit und Gesundheitsschutz bei Tätigkeiten mit biologischen Arbeitsstoffen (Biostoffverordnung, BioStoffV). Hiernach handelt es sich gemäß §2 Absatz 8 um gezielte Tätigkeiten. Diese liegen vor, wenn die folgenden Voraussetzungen erfüllt sind:
- Die Tätigkeiten sind auf einen oder mehrere biologische Arbeitsstoffe unmittelbar ausgerichtet,
- biologische Arbeitsstoffe sind mindestens der Spezies nach bekannt und
- die Exposition der Beschäftigten im Normalbetrieb ist hinreichend bekannt oder abschätzbar.
Hinsichtlich der Ausführung geben die technischen Regeln für biologische Arbeitsstoffe (TRBA) konkrete und praktische Hinweise. Für das Arbeiten in Laboratorien von Apotheken ist die TRBA 250 relevant.
Risikogruppen
Nach §3 Abs. 1 BioStoffV werden biologische Arbeitsstoffe nach dem von ihnen ausgehenden Infektionsrisiko nach dem Stand der Wissenschaft in vier Risikogruppen eingeteilt. Hier sind für die direkte Anwendung von Viren am Menschen im Rahmen von klinischen Studien allerdings nur die ersten beiden Risikogruppen relevant. Risikogruppe 1 umfasst biologische Arbeitsstoffe, bei denen es unwahrscheinlich ist, dass sie beim Menschen eine Krankheit hervorrufen, während dies bei Risikogruppe 2 möglich ist, aber auch eine wirksame Vorbeugung oder Behandlung normalerweise möglich ist.
Für die Einstufung in die Risikogruppe 2 bis 4 gilt Anhang III der Richtlinie 2000/54/EG des Europäischen Parlaments und Rates vom 18. September 2000. Für konkrete Informationen zur Einstufung von Viren in Risikogruppen seien hier auch TRBA 462 erwähnt (Abb. 1).
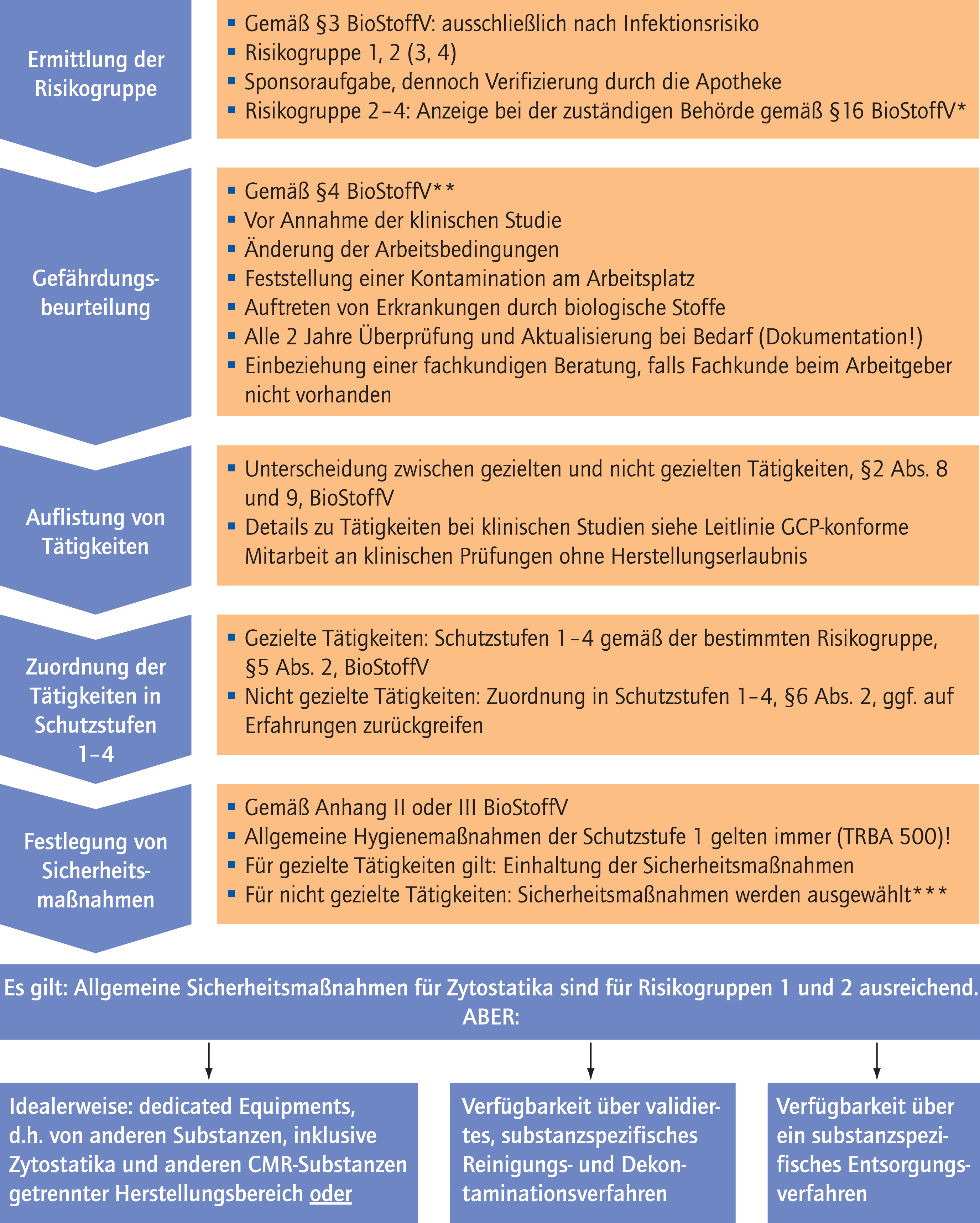
Abb. 1. Einordnung von biologischen Arbeitsstoffen in Risikogruppen und Ableitung von Sicherheitsmaßnahmen gemäß Biostoffverordnung (BioStoffV). *Anzeige ist Sponsoraufgabe; **bei mehreren biologischen Arbeitsstoffen: einzelne Betrachtung und Bewertung; ***in Einzelfällen kann es erforderlich sein, aus einer Schutzstufe weitere Sicherheitsmaßnahmen auszuwählen, wenn dadurch das Risiko der Kontamination und die Gefährdung der Beschäftigten erheblich reduziert werden kann.
Beurteilung der Gefährdung
Für die Gefährdungsbeurteilung sind analog der Zytostatika-Herstellung die entsprechenden Informationen zu beschaffen (vgl. §4 BioStoffV). Hilfestellung zur Durchführung der Gefährdungsbeurteilung geben hierfür die TRBA 400 anhand von Beispielen. Im Rahmen der Gefährdungsbeurteilung sind für alle gezielten Tätigkeiten zudem notwendige Schutzmaßnahmen sowie die erwähnte Risikogruppe zu ermitteln. Verfügt der Arbeitgeber nicht selbst über die entsprechenden Kentnisse, so hat er sich fachkundig beraten zu lassen. Die Definition der „Fachkunde“ wird in §2 Abs. 11 gegeben. In jedem Fall sind eine geeignete Berufsausbildung und eine zeitnahe einschlägige berufliche Tätigkeit nachzuweisen.
Die Ergebnisse der Gefährdungsbeurteilung sind zu dokumentieren und unverzüglich zu aktualisieren, wenn
1. maßgebliche Veränderungen der Arbeitsbedingungen oder neue Informationen, zum Beispiel Unfallberichte oder Erkenntnisse aus arbeitsmedizinischen Vorsorgeuntersuchungen, dies erfordern oder
2. die Prüfung von Funktion und Wirksamkeit der Schutzmaßnahmen ergeben hat, dass die festgelegten Schutzmaßnahmen nicht wirksam sind.
Ansonsten hat der Arbeitgeber die Gefährdungsbeurteilung mindestens jedes zweite Jahr zu überprüfen und bei Bedarf zu aktualisieren. Ergibt die Überprüfung, dass eine Aktualisierung der Gefährdungsbeurteilung nicht erforderlich ist, so hat der Arbeitgeber dies unter Angabe des Datums der Überprüfung in der Dokumentation nach §7 zu vermerken.
Ist der Arbeitsstoff der Risikogruppe 2 bis 3 zuzuordnen, besteht eine Anzeigepflicht bei der zuständigen Behörde spätestens 30 Tage vor Aufnahme oder Einstellung der Tätigkeiten. In Gesundheitseinrichtungen ist die Aufnahme von Tätigkeiten der Schutzstufe 4 nach §15 BioStoffV nur mit Erlaubnis der Behörde möglich. Im Falle der Zuordnung der Tätigkeiten zu einer der Risikogruppen 2 bis 4 sind zudem die §§8 bis 14 BioStoffV relevant (konkretisiert in TRBA 250), welche die Schutzmaßnahmen, Hygienemaßnahmen, Schulung, Unterweisung, Anzeige und Aufzeichnung, sowie arbeitsmedizinische Vorsorge und behördliche Vorgaben regeln.
Schutzstufen
In Abhängigkeit der ausgehenden Gefährdungen sind den auszuführenden Tätigkeiten im Falle von gezielten Tätigkeiten in Einrichtungen des Gesundheitsdienstes nach §5 BioStoffV die relevanten Schutzstufen (1–4) zuzuordnen. Diese richten sich nach der Risikogruppe des ermittelten Biostoffs. Zur Festlegung der Schutzstufen gibt die TRBA 250 konkrete Hinweise. Bei allen Tätigkeiten mit biologischen Arbeitsstoffen müssen die allgemeinen Hygienemaßnahmen der Schutzstufe 1 nach Anhang II oder III der BioStoffV beachtet werden. Diese finden sich in den vom Ausschuss für Biologische Arbeitsstoffe (ABAS) festgelegten technischen Regeln (TRBA 500). Für die zu gewährleistenden Sicherheitsmaßnahmen in den Schutzstufen 2 bis 4 ist Anhang II der BioStoffV „Sicherheitsmaßnahmen bei Tätigkeiten mit biologischen Arbeitsstoffen in Laboratorien und laborähnlichen Einrichtungen“ relevant. Weiterhin sollten Prozessdetails durch entsprechende Arbeitsanweisungen definiert werden. Hinsichtlich der Entsorgung empfiehlt sich die ausschließliche Verwendung von Einmalmaterialien (Schutzkleidung, Abwurfboxen unter der Werkbank, Medizinprodukte), die sofort nach Herstellung im verschließbaren Müllbehältnis entsorgt werden, um die Notwendigkeit von Dekontaminationen des Arbeitsmaterials zu vermeiden. Anweisungen für weitere Entsorgungsmaßnahmen wie Autoklavieren zur Inaktivierung der Viren unterliegen der Verantwortung des Sponsors.
Umsetzung der Anforderungen in die Praxis
In den Schutzstufen 2 bis 3 vorgeschriebene Sicherheitsmaßnahmen decken sich im Wesentlichen mit den Anforderungen zur Zytostatika-Herstellung: Sie können in entsprechenden Reinräumen sowie einer Sicherheitswerkbank (DIN12980) in der Regel durch eine Krankenhausapotheke gewährleistet werden, welche Expertise in der Herstellung von CMR-Arzneimitteln besitzt. Voraussetzung ist allerdings, dass die Herstellung getrennt von anderen Produkten stattfinden kann. Idealerweise sollte die Herstellung des biologischen Arbeitsstoffs in einem von Zytostatika und anderen CMR-Substanzen getrennten Herstellungsbereich stattfinden. Ist dies nicht gegeben, sollte ein substanzspezifisches Reinigungs- und Dekontaminationsverfahren verfügbar sein. Hier ist besonders darauf zu achten, dass eine ausreichende Dekontaminationszeit gewährleistet wird (abhängig von den Eigenschaften des Virus, sowie des definierten Reinigungsmittels). Reinigungs- und Dekontaminationsverfahren fallen ebenso in die Verantwortung des Sponsors. Die Apotheke sollte vor Studienbeginn sicherstellen, dass diese Unterlagen vorhanden sind und durch die Behörde genehmigt wurden.
Zum Zeitpunkt des Herstellungsprozesses sowie der Dekontamination sollte der Zutritt zum abgeschlossenen Bereich zudem auf eine definierte Anzahl an Personen begrenzt sein.
Fazit
Aufgrund der bereits vorhandenen Erfahrung im Umgang mit Gefahrstoffen und klinischen Prüfpräparaten als auch der Kompetenz im Bereich der patientenindividuellen aseptischen Zubereitung können Klinikapotheken ohne Zweifel als optimale Ansprechpartner für die Herstellung von virushaltigen Zubereitungen im Rahmen von klinischen Studien angesehen werden. Krankenhausapotheker sollten daher die Herstellung dieser neuartigen Therapien übernehmen und den klinischen Fortschritt in der Behandlung von malignen Tumorerkrankungen unterstützen.
Literatur
Verordnung über Sicherheit und Gesundheitsschutz bei Tätigkeiten mit biologischen Arbeitsstoffen vom 15.07.2013 (BGBl. I S. 2514).
RL 2000/54/EG: Richtlinie Biologische Arbeitsstoffe, kodifizierte Fassung der Richtlinie 90/679/EWG über den Schutz der Arbeitnehmer gegen Gefährdung durch biologische Arbeitsstoffe bei der Arbeit (Amtsblatt der Europäischen Gemeinschaft Nr. L 262/21–45 vom 17.10.2000).
TRBA 001 „Allgemeines und Aufbau des Technischen Regelwerks zur Biostoffverordnung Anwendung von Technischen Regeln für Biologische Arbeitsstoffe (TRBA) (Hinweise des Bundesministeriums für Wirtschaft und Arbeit)“ (GMBl. Nr. 4 vom 14.02.2008 S. 71).
TRBA 100 „Schutzmaßnahmen für gezielte und nicht gezielte Tätigkeiten mit biologischen Arbeitsstoffen in Laboratorien“ (GMBl. Nr. 51/52 vom 17.10.2013 S. 1010).
TRBA 250 „Biologische Arbeitsstoffe im Gesundheitswesen und in der Wohlfahrtspflege“ (Bundesarbeitsblatt 11/2003, S. 53–73).
TRBA 400 „Handlungsanleitung zur Gefährdungsbeurteilung bei Tätigkeiten mit biologischen Arbeitsstoffen“ (BArbBl. 6/2006 S. 62).
TRBA 450 „Einstufungskriterien für Biologische Arbeitsstoffe“ (Bundesarbeitsblatt. 6/00, S. 58–61 mit Änderungen und Ergänzungen: Bundesarbeitsblatt 4/02, S. 127–128, Bundesarbeitsblatt 10/02, S. 86 und Bundesarbeitsblatt 11/04 S. 25).
TRBA 462 „Einstufung von Viren in Risikogruppen“ (GMBl. Nr. 15-20 vom 25.04.2012, S. 299).
TRBA 500 „Allgemeine Hygienemaßnahmen: Mindestanforderungen“ (GMBl. Nr. 15-20 vom 25.04.2012, S. 373).
Krankenhauspharmazie 2013; 34(12)
