Inhaltsverzeichnis
I Präambel
II Zweckbestimmung und Geltungsbereich
III Regulatorische Anforderungen
III-1 Qualifikation des Personals
IV Anfragebearbeitung in Krankenhausapotheken
IV-1 Anfrage aufnehmen
IV-1.1 Fragesteller, Kontaktdaten und Dringlichkeit
IV-1.2 Hintergrundinformationen erfassen
IV-2 Klassifikation der Anfrage
IV-3 Recherche
IV-4 Analyse und Bewertung der Daten
IV-5 Weitergabe der Daten
IV-6 Dokumentation
IV-7 Follow-up
IV-8 Maßnahmen der Qualitätssicherung
V Verabschiedung
I Präambel
Die Information und Beratung von Ärzten und Pflegekräften zur Auswahl und Anwendung von Arzneimitteln ist eine gesetzlich vorgeschriebene Aufgabe des Krankenhausapothekers [3, 20]. Sie ist Teil der im Leitbild des Krankenhausapothekers geforderten „Schaffung des bestmöglichen Nutzens der Arzneimitteltherapie für den Patienten“ [40]. Unter Arzneimittelinformation im Sinne dieser Leitlinie wird die Erfassung und Bearbeitung komplexer Anfragen zu Arzneimitteln, der Arzneimitteltherapie, Medizinprodukten, Nahrungsergänzungsmitteln oder anderen apothekenüblichen Waren verstanden. Diese können einen bestimmten Patienten oder eine Patientengruppe betreffen. Die Arzneimittelinformation dient der Gewährleistung einer sicheren und effektiven Arzneimitteltherapie. Arzneimittelinformation gehört zu den zentralen klinisch-pharmazeutischen Dienstleistungen im Krankenhaus. In internationalen Untersuchungen konnte gezeigt werden, dass der Arzneimittelinformationsservice der Krankenhausapotheke Ärzte in der medizinischen Entscheidungsfindung unterstützt, das Patienten-Outcome verbessert, die Mortalität der Patienten und Behandlungskosten senkt [7, 8, 11, 12, 25, 28, 46].
II Zweckbestimmung und Geltungsbereich
Diese Leitlinie dient der Qualitätssicherung der Arzneimittelinformation aus der Krankenhausapotheke. Sie legt basierend auf der „ADKA-Leitlinie für Leitlinien“ [29] und korrespondierend zur Leitlinie der Bundesapothekerkammer „Arzneimittelinformation in der Apotheke und Informationsstellen der Apothekerschaft“ [13] den Standard für Arzneimittelinformation aus Krankenhausapotheken fest. Sie gilt insbesondere für Arzneimittelinformationsabteilungen in Krankenhausapotheken, die Anfragen von Ärzten, Pflegekräften, weiteren medizinischen Berufsgruppen, Verwaltung, Patienten und deren Angehörigen oder Pflegenden sowie weiteren Fragestellern beantworten.
Der Arzneimittelinformationsservice der Krankenhausapotheke stellt für die Zielgruppe auf einfach zugänglichem Weg unabhängige, evidenzbasierte und patientenindividuelle Informationen bereit. Daten aus der nationalen und internationalen Literatur und klinisch-pharmazeutisches Fachwissen werden kombiniert, um Mitarbeitern des Gesundheitswesens und Patienten eine bessere Basis für komplexe klinische Entscheidungen zur Verfügung zu stellen, die über klinische Routinequellen oder Informationen aus dem Internet hinausgeht.
Diese Leitlinie ist eine Praxisleitlinie und basiert nicht streng auf den Kriterien der evidenzbasierten Leitlinienerstellung. Dies erfolgt aufgrund der Tatsache, dass keine Studien zur systematischen Durchführung der Arzneimittelinformation, sondern lediglich zu Teilaspekten verfügbar sind. Internationale Leitlinien zum Thema folgen der gleichen Vorgehensweise [21, 53, 57]. Vorhandene Evidenz zu Teilaspekten wird in der Leitlinie als Evidenzaspekte unter dem jeweiligen Teilschritt aufgeführt.
Ziel der Leitlinie ist es, Qualitätskriterien für die Arzneimittelinformation aus der Krankenhausapotheke zu definieren und Hilfestellungen für die Beschaffung, Bewertung, Weitergabe und Dokumentation von Informationen zu geben. Der Prozess der Arzneimittelinformation wird detailliert dargestellt und grundlegende Anforderungen an die Prozess- und Strukturqualität werden benannt, um eine möglichst hohe Ergebnisqualität sicherzustellen.
Diese Leitlinie ist Revision 2 der ersten Fassung von 2009. Sie trat am 15.09.2021 in Kraft. Die Arzneimittelinformation aus der Krankenhausapotheke unterliegt ständiger Weiterentwicklung und wissenschaftlicher Evaluation. Daher ist die Leitlinie kontinuierlich dem Stand der Wissenschaft anzupassen. Eine nächste Aktualisierung ist für 2026 vorgesehen.
III Regulatorische Anforderungen
Laut § 14 ApoG und § 27 ApBetrO hat der Leiter der Krankenhausapotheke dafür zu sorgen, dass ein Krankenhausapotheker das Personal des Krankenhauses im Hinblick auf eine sichere, zweckmäßige, qualitativ hochwertige und wirtschaftliche Arzneimitteltherapie und Anwendung der Arzneimittel oder apothekenpflichtigen Medizinprodukte sowie, soweit erforderlich, Patienten, insbesondere im Zusammenhang mit ihrer Entlassung, im Hinblick auf eine sichere Arzneimittelanwendung, berät [3, 20]. Nach § 2a ApBetrO muss der Leiter der Apotheke ein Qualitätsmanagementsystem entsprechend Art und Umfang der pharmazeutischen Tätigkeiten betreiben, das betriebliche Abläufe festlegt und dokumentiert [3]. Das Qualitätsmanagementsystem muss unter anderem eine ausreichende Beratungsleistung gewährleisten. Tätigkeiten der Arzneimittelinformation sind dementsprechend im Qualitätsmanagementsystem zu verankern.
Die DIN EN 15224:2017 ist eine bereichsspezifische unabhängige Norm des Qualitätsmanagements im Gesundheitswesen, die auf der branchenunabhängigen ISO 9001:2015 beruht und als Leitnorm angesehen wird. Unter den dort definierten 11 Qualitätsmerkmalen der Gesundheitsversorgung ist die qualitätsgesicherte Arzneimittelinformation insbesondere für die Punkte „evidenzbasierte/wissensbasierte Versorgung“ und „Patientensicherheit“ von Bedeutung [17].
Nach § 135a SGB V sind Leistungserbringer zur Qualitätssicherung verpflichtet. Dazu gehört, dass Leistungen dem jeweiligen Stand der wissenschaftlichen Erkenntnisse entsprechen und in der fachlich gebotenen Qualität erbracht werden müssen. Insbesondere Krankenhäuser sind demnach verpflichtet, sich an einrichtungsübergreifenden Maßnahmen der Qualitätssicherung zu beteiligen. U. a. darauf basierend erfragt der Gemeinsame Bundesausschuss zum Qualitätsbericht der Krankenhäuser unter Punkt A-12.5 Angaben zur Arzneimitteltherapiesicherheit [19]. Der Arzneimittelinformationsservice der Krankenhausapotheke kann als zusätzliche Freitexteingabe bei den Instrumenten und Maßnahmen der AMTS aufgeführt werden.
Laut § 28 ApBetrO muss das für einen ordnungsgemäßen Betrieb der Krankenhausapotheke notwendige Personal, insbesondere auch das pharmazeutische Personal, in ausreichender Zahl vorhanden sein [3]. Die personelle Ausstattung muss eine qualitätsgesicherte und termingerechte Arzneimittelinformation ermöglichen.
Qualitätsnormen wie die interdisziplinär entwickelten Statements der Europäischen Krankenhausapotheker fordern die Informationsbeschaffung und Informationsweitergabe durch Einbindung der Krankenhausapotheker insbesondere in den Statements 4.6, 4.7, 5.1 und 5.9 [66].
Für die Erhebung, Verarbeitung oder Nutzung persönlicher Daten von Patienten sind die geltenden Bestimmungen des Datenschutzes und die apothekerliche Schweigepflicht einzuhalten [16, 54].
III-1 Qualifikation des Personals
Die Information und Beratung über Arzneimittel ist eine pharmazeutische Tätigkeit gemäß § 2 Abs. 3 Nr. 7 der Bundes-Apothekerordnung [14]. Aufgrund der Komplexität des Aufgabengebiets und der Verantwortung für klinische Empfehlungen muss mindestens ein Apotheker mit Berufserfahrung im betreffenden Sachgebiet verantwortlich tätig sein. Die Leitung der Abteilung Arzneimittelinformation muss durch einen Fachapotheker für Klinische Pharmazie oder Fachapotheker für Arzneimittelinformation erfolgen. Alle Mitarbeiter müssen sich regelmäßig fortbilden. Die Fortbildung muss dokumentiert sein. Apotheker, die im Bereich Arzneimittelinformation tätig sind, sollten über Erfahrung in der Arbeit auf Station verfügen. Grundsätzlich sollen die Erarbeitung und Weitergabe der Informationen Aufgabe des Apothekers sein. Der Apotheker kann im Rahmen der Recherche Teilaufgaben an weiteres pharmazeutisches Personal delegieren, muss aber selbst immer die letzte Kontrollinstanz vor der Weitergabe der Informationen an den Anfragenden sein. Er trägt für die Qualität und Richtigkeit der Informationen sowie für die ordnungsgemäße und rechtzeitige Weitergabe die Verantwortung. Im Rahmen des Qualitätsmanagementsystems sind Festlegungen zur Freigabe bearbeiteter Anfragen zu treffen.
Evidenzaspekte
Nach den Ergebnissen des 1. Ringversuches Arzneimittelinformation der ADKA beeinflusst die personelle Ausstattung die Qualität. Apotheken mit einer eigenen Abteilung Arzneimittelinformation erzielten bessere Ergebnisse als Apotheken, bei denen diese Aufgabe zusätzlich zu anderen Routineaufgaben bearbeitet wurde [55].
Mitarbeiter mit geringer Erfahrung in der Arzneimittelinformation benötigen eine längere Bearbeitungszeit zur Bearbeitung von Anfragen (1 Jahr Erfahrung 90 min länger als Mitarbeiter mit 2 Jahren Erfahrung) [43].
In einer Studie zeigte sich insgesamt nur eine schwache Korrelation zwischen Bearbeitungszeit und Qualität der Antwort, eine längere Bearbeitungsdauer resultierte in der Bewertung durch Allgemeinärzte sogar in einer geringeren qualitativen Beurteilung [44].
IV Anfragebearbeitung in Krankenhausapotheken
Die Bearbeitung komplexer Anfragen der Arzneimittelinformation in der Krankenhausapotheke soll in einer systematischen Vorgehensweise erfolgen, um eine hohe Ergebnisqualität sicherzustellen. Diese Empfehlung basiert auf der in der Literatur beschriebenen praktischen Vorgehensweise und entspricht dem international etablierten und anerkannten Standard [1, 18, 21, 26, 30, 33, 53, 57, 61, 64]. Die systematische Vorgehensweise ist im Qualitätsmanagementsystem festzulegen. In der Literatur finden sich verschiedene systematische Vorgehensweisen, die sich in der genauen Unterteilung der Schritte aber nur geringfügig unterscheiden. Ein übliches Vorgehen umfasst die folgenden Schritte:
- Anfragenaufnahme
- Klassifikation der Anfrage
- Recherche
- Analyse und Bewertung der Daten
- Weitergabe der Informationen
- Dokumentation
- Follow-up/Feedback
In Abbildung 1 ist die systematische Vorgehensweise der Arzneimittelinformation mit kurzen Erläuterungen dargestellt. Nachfolgend werden die einzelnen Schritte ausführlicher erläutert.
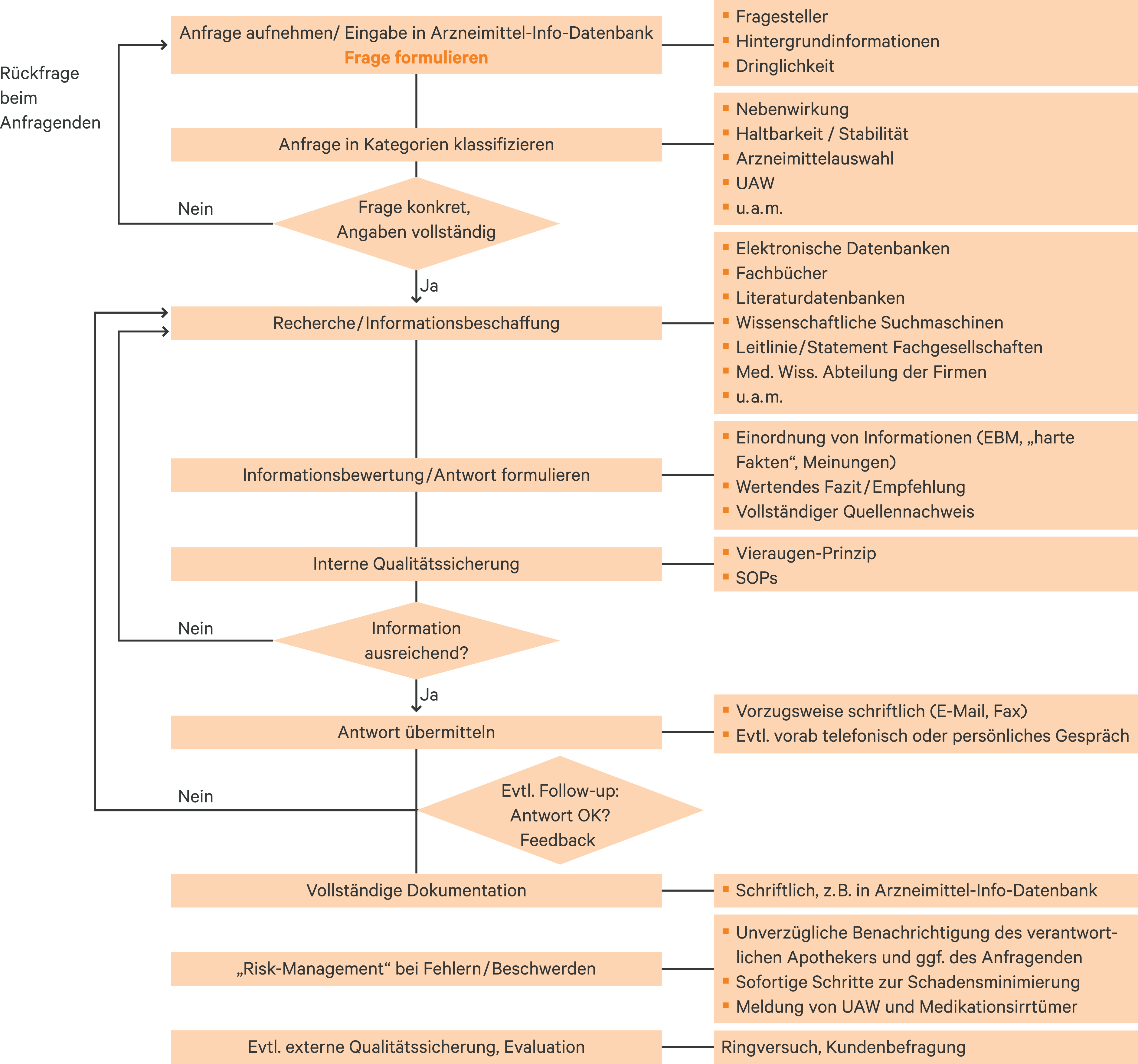
Abb. 1. Systematische Vorgehensweise der Arzneimittelinformation
IV-1 Anfrage aufnehmen
Dieser Schritt umfasst die eindeutige Identifizierung des Fragestellers, die Aufnahme der Kontaktdaten, Klärung der Dringlichkeit der Anfrage und des präferierten Antwortweges, Definition der genauen Fragestellung und Erfassung aller relevanten Hintergrundinformationen.
IV-1.1 Fragesteller, Kontaktdaten und Dringlichkeit
Anfragen an die Arzneimittelinformation der Krankenhausapotheke werden von sehr unterschiedlich informierten Personengruppen gestellt. Diese Tatsache ist bei der Recherchestrategie, der Art und Weise der Informationsweitergabe und der Formulierung der Antwort zu berücksichtigen. Fragesteller können Ärzte, Pflegepersonal, Apotheker, Patienten oder sonstige Personengruppen sein. Durch Rückfragen sollte der genaue Kenntnisstand des Fragestellers zum Problem erfasst werden, da auch innerhalb einer Berufsgruppe Unterschiede im Vorwissen vorliegen. Dies schließt gegebenenfalls die Angabe der medizinischen Spezialisierung (z. B. Facharzt für …), des genauen Tätigkeitsfelds (z. B. Intensiv- oder Normalpflege) und bereits kontaktierter Recherchequellen mit ein. Name und Kontaktdaten des Fragestellers müssen korrekt erfasst werden, um die Antwortübermittlung sicherzustellen und gegebenenfalls ein Follow-up durchführen zu können. In Rücksprache mit dem Fragesteller ist die Dringlichkeit zu klären. Zum vereinbarten Termin sollte der Fragesteller kontaktiert werden und das Ergebnis oder, sofern die Anfrage noch nicht abschließend beantwortet werden kann, das Zwischenergebnis mitgeteilt werden.
IV-1.2 Hintergrundinformationen erfassen
Die Erfassung von Hintergrundinformationen dient der genauen Fokussierung der Fragestellung und der Festlegung der Recherchestrategie. Dieser kritische Schritt stellt sicher, dass in der Beantwortung der Frage wirklich klinisch relevante Informationen bereitgestellt werden können [1, 30, 33, 64]. Wichtige Hintergrundinformationen sind u. a.:
- Wozu wird die Information benötigt (z. B. Patient, Patientengruppe, hausinterne Leitlinie, eigene Weiterbildung)?
- Welche (therapeutischen) Konsequenzen werden aus der Antwort gezogen?
In Abhängigkeit von der genauen Fragestellung können bei patientenbezogenen Fragen folgende Parameter relevant sein und sind bei der Anfragenaufnahme zu erfassen [1, 33, 64]:
- Alter, Geschlecht, Gewicht
- Spezifische medizinische Zustände wie Schwangerschaft, Stillzeit, Dialyse, Zustand nach Transplantation
- Relevante Labordaten
- Organfunktion (Leber, Niere)
- Derzeitige Diagnosen und komplette Medikation, gegebenenfalls Allergien und Vormedikation
- Lebensweise (Substanzabusus, Raucher, Allgemeinzustand, Ernährungszustand, soziales Umfeld)
Eine praxistaugliche Hilfe, welche Hintergrundinformationen bei welchem Themengebiet relevant sind, stellt der Quick Question Guide des UKMI (United Kingdom Medicines Information) dar, der auch als deutsche Übersetzung vorliegt [51].
Welche Hintergrundinformationen zu erfragen sind, muss fallbezogen entschieden werden. Es sollten nur die relevanten Informationen abgefragt werden. Häufig ändert oder erweitert sich durch die Hintergrundinformationen die initiale Fragestellung. Diese tatsächliche Frage sollte zum Abschluss des Gesprächs zusammenfassend dem Fragesteller wiederholt werden, um eine effiziente Suche klinisch relevanter Daten sicherzustellen.
Evidenzaspekte
Unzureichende Erfassung von Hintergrundinformationen führte in einer Untersuchung an vier amerikanischen Arzneimittelinformationszentren mit Testanfragen zu falschen und unzureichenden Antworten und Empfehlungen [15].
IV-2 Klassifikation der Anfrage
Die Klassifikation der Anfrage dient als Grundlage der strukturierten Recherche und der statistischen Auswertung. Die Zuordnung zu einem Themengebiet ermöglicht eine rasche Suche in den thematisch relevanten Quellen [64]. Anlage 1 zeigt wichtige Themengebiete mit einer exemplarischen Auswahl von Print- und Online-Quellen.
IV-3 Recherche
Der für den Bereich Arzneimittelinformation verantwortliche Apotheker muss sicherstellen, dass für verschiedene Themengebiete geeignete und ausreichende Quellen der Primär-, Sekundär- und Tertiärliteratur verfügbar sind. Bei der Beschaffung und Nutzung der Quellen müssen die Besonderheiten hinsichtlich Aktualität, Abstraktionsgrad, Breite der Informationen und sichere Verfügbarkeit berücksichtigt werden. Die Nutzung wesentlicher Literatur- und Faktendatenbanken sollte sichergestellt sein.
Der verantwortliche Apotheker hat dafür zu sorgen, dass die verfügbaren Quellen dem jeweils aktuellen Stand der Wissenschaft entsprechen. Es sollte in Anlehnung an Anlage 1 ein apothekeninterner Leitfaden mit Recherchequellen für die einzelnen Anfragethemen erstellt werden. Als weitere Hilfe können die „Enquiry Answering Guidelines“ des UKMI hinzugezogen werden [57].
Prinzipiell ist der aktuelle Stand der Wissenschaft zu recherchieren und weiterzugeben. Im Sinne der evidenzbasierten Medizin ist die beste verfügbare Evidenz für die spezifische Fragestellung zu eruieren. Dabei ist die Tiefe der Recherche, ob z. B. die Originalpublikationen aufzusuchen sind oder Angaben aus der Tertiärliteratur ausreichen, der genauen Fragestellung und dem Adressaten anzupassen.
Für eine korrekte Recherche sind mindestens zwei unabhängige Quellen heranzuziehen, da Datenbanken häufig nicht vollständig sind und Unterschiede in der Verwendung von Primärquellen, länderspezifischen Besonderheiten, Aktualität und Nutzbarkeit von Informationen bestehen.
Evidenzaspekte
Umfangreiche vergleichende Untersuchungen zur Vollständigkeit, Aktualität und Nutzbarkeit von Informationen in pharmazeutisch-medizinischen Datenbanken zeigen deutliche Unterschiede bis hin zu widersprüchlichen Angaben [31, 32, 34, 35, 41, 50, 59 u. a.]. Die Verwendung mehrerer, unabhängiger Quellen ist für eine korrekte Recherche erforderlich.
Verschiedene Studien untersuchten die Art und Anzahl verwendeter Quellen in Antworten auf Anfragen an Arzneimittelinformationsstellen [z. B. 22, 49]. Die Variationsbreite verwendeter Quellen war hoch, teilweise themenspezifisch sehr breit gefächert. Da keine Korrelation zur Korrektheit der Antworten vorgenommen wurde, ist keine Aussage hinsichtlich der Anzahl der zu verwendenden Quellen möglich.
Sofern dies relevant ist, sind die Fachinformationen der betroffenen Präparate heranzuziehen und ihre Angaben als Mindeststand des Wissens aus rechtlicher Sicht zu berücksichtigen. Dabei ist zu beachten, dass Fachinformationen teilweise unterschiedlich vollständig hinsichtlich einzelner Angaben sind und ggf. mehrere Fachinformationen konsultiert werden müssen. Zusätzlich ist die genaue Quelle für Aussagen aus Fachinformationen anzugeben. Die von der amerikanischen Food and Drug Administration genehmigte Summary of Product Characteristics kann zusätzliche Angaben enthalten und eine Konsultation je nach Fragestellung sinnvoll sein.
Evidenzaspekte
Nach verschiedenen Untersuchungen führen Fachinformationen verschiedener Präparate eines Wirkstoffs divergierende Angaben auf, z. B. zu Kontraindikationen und Maßnahmen bei Vergiftungen, bzw. Fachinformationen zweier potenzieller Interaktionspartner verschiedene Angaben zu möglichen Wechselwirkungen [6, 37, 47, 60].
Studien zeigen, dass Fachinformationen nicht alle von den Zulassungsbehörden geforderten Angaben enthalten [z. B. 4, 39, 62]. Es finden sich divergierende bzw. ergänzende Angaben zwischen den Summary of Product Characteristics im Zulassungsgebiet der EU und den USA [z. B. 42, 48].
Insbesondere bei der Nutzung des Internets ist die Validität der kontaktierten Quellen zu bewerten. Die divergierende Qualität und Verlässlichkeit der Angaben auf institutionellen, kommerziellen und sonstigen Seiten muss angemessen berücksichtigt werden. Vor- und Nachteile von Literaturdatenbanken und wissenschaftlichen Suchmaschinen sind für eine zeitsparende und vollständige Recherche angemessen abzuwägen. Hinweise zur sicheren Recherche im Internet für die Arzneimittelinformation können z. B. einer Zusammenfassung des United Kingdom Medicines Information Service entnommen werden [58].
Evidenzaspekte
Diverse Studien zeigen Vor- und Nachteile bei Verwendung bzw. Kombination von medizinischen Literaturdatenbanken, wissenschaftlichen Suchmaschinen und allgemeinen Internetquellen [z. B. 9, 10, 23]. Diese müssen dem Apotheker der Arzneimittelinformation bekannt sein und für eine umfassende und zeitsparende Recherche Anwendung finden.
Beim Umgang mit Primärliteratur ist nach Möglichkeit auf den Volltext zurückzugreifen bzw. sind Limitationen bei der Verwendung von Abstracts (z. B. verkürzte oder unklare Aussagen, Nennung nur positiver Ergebnisse) zu berücksichtigen.
Evidenzaspekte
Studien zeigen teilweise abweichende, oft positivere Aussagen in Abstracts gegenüber dem Volltext von Publikationen [2, 38].
IV-4 Analyse und Bewertung der Daten
Die bei der Recherche gesammelten Informationen sind zusammenzuführen, zu beurteilen und zu interpretieren. Die Informationen sind im Hinblick auf Vollständigkeit, praxisnahe Beantwortung der Frage und Aktualität zu bewerten. Die kritische Evaluation muss auch die Validität der Datenquellen berücksichtigen, z. B. Aktualität, thematischer Fokus der Quelle, Fachkompetenz der Autoren, Angabe von Referenzen und mögliche Bias [1]. Wurde nach Primärliteratur zur Fragestellung gesucht, ist kritisch zu hinterfragen, ob die richtigen Sekundärquellen zum Auffinden genutzt und die optimale Suchtechnik verwendet wurde [1, 33]. Die Gewichtung der Rechercheergebnisse und die daraus resultierenden Interpretationen sollen nach evidenzbasierten Kriterien erfolgen, wie sie z. B. über das Deutsche Netzwerk Evidenzbasierte Medizin verfügbar sind (www.ebm-netzwerk.de). Die klinische Relevanz der Rechercheergebnisse soll dargestellt werden, damit der Fragesteller die Daten besser einordnen und klinisch nutzen kann.
Evidenzaspekte
Studien haben gezeigt, dass Ergebnisse eines Interaktionstests besser klinisch umgesetzt werden, wenn sie nach Schweregrad klassifiziert wurden [36].
Das europaweit definierte Vokabular zur Häufigkeit von unerwünschten Arzneimittelnebenwirkungen ist Ärzten nicht allgemein vertraut, die Angaben sollten zusätzlich als Zahl erfolgen [65].
Die Darstellung von Nebenwirkungshäufigkeiten in Prozent gegenüber Placebo führte zu korrekteren Einschätzungen einer unerwünschten Arzneimittelwirkung als die Darstellung in Prozent oder verbal ohne Vergleichsangabe [31].
IV-5 Weitergabe der Informationen
Die Beantwortung der Frage muss objektiv, ausgewogen und unabhängig von Interessen Dritter erfolgen. Die Informationen sollen logisch und klar verständlich dargestellt werden. Widersprüchliche Daten müssen korrekt präsentiert werden. Gibt es zu den angefragten Sachverhalten keine Daten oder ist die Anfrage unter Ausschöpfung aller Quellen nicht oder nicht eindeutig zu beantworten, so muss dies dokumentiert und bei der Weitergabe an den Anfragenden dargestellt werden.
Meinungen und Fakten sind klar zu trennen [63].
Die Formulierung eines Fazits bzw. einer Empfehlung ist anzustreben. In Abhängigkeit von der Qualifikation des Anfragenden ist auf die Erklärung von Fachbegriffen und Abkürzungen zu achten und eine angemessene, verständliche Sprache zu verwenden.
Rechtliche Aspekte, z. B. Angaben zu zugelassenen und nicht zugelassenen Indikationen, sind angemessen zu berücksichtigen.
Evidenzaspekte
Die Qualität von schriftlichen Antworten auf Testanfragen der Arzneimittelinformation wurde in einer Untersuchung von einem Expertenpanel aus Pharmazeuten, Ärzten und Sprachwissenschaftlern besser bewertet, wenn spezifische Empfehlungen und Schlussfolgerungen präsentiert wurden. Negativ wirkten sich nicht erklärte, unübliche Abkürzungen und Begriffe aus sowie unkommentierte Studienergebnisse und eine zu verdichtete und passive Sprache [45].
Antworten auf Anfragen müssen zum vereinbarten Zeitpunkt (ggf. Vorabinformation), dem Kenntnisstand des Fragestellers entsprechend formuliert und auf dem vereinbarten Weg (z. B. Telefon, Fax, E-Mail) übermittelt werden. Die Anfrage soll nach Möglichkeit schriftlich beantwortet werden. Abhängig von der Dringlichkeit und dem Bedarf des Fragestellers kann die Anfrage auch vorab persönlich oder telefonisch beantwortet werden. Es ist im Rahmen des Qualitätsmanagementsystems empfehlenswert, dem Anfragenden die Möglichkeit eines Feedbacks zu geben, ein internes Fehlerprotokoll zu führen und ein Fehlermanagement zu etablieren.
IV-6 Dokumentation
Die Dokumentation der Anfragen erfolgt aus rechtlichen Gründen, zur schnellen Bearbeitung von Rückfragen, als Datenbasis für spätere Anfragen und zur Darstellung erbrachter klinischer Leistungen [64]. Dokumentiert werden sollten mindestens Fragesteller mit Kontaktdaten, Frage, Antwort und Rechercheweg. Empfehlenswert ist zudem die Erfassung des Zeitaufwands und des Themengebiets für spätere Auswertungen. Optimal ist eine EDV-gestützte Dokumentation, z. B. mit der Arzneimittel-Info-Datenbank der ADKA. Falls dies nicht möglich ist, können andere Dokumentationssysteme genutzt werden, die einen schnellen und eindeutigen Zugriff auf die beantworteten Fragen ermöglichen.
IV-7 Follow-up
Das Follow-up umfasst zum einen die unmittelbare Rückmeldung auf die Beantwortung einer Frage. Es ist zu klären, inwiefern die Antwort für die Fragestellung inhaltlich passend und ausreichend war. Zusätzliche, neue Fragen sollen identifiziert und gegebenenfalls aufgenommen werden. Das Follow-up bietet zum anderen die Möglichkeit, zu lernen, wie Antworten in die Praxis umgesetzt werden und zu welchem klinischen Ergebnis sie führen.
IV-8 Maßnahmen zur Qualitätssicherung
Maßnahmen zur Qualitätssicherung sollten im apothekeninternen Qualitätsmanagement in Form von Verfahrens- und Arbeitsanweisungen festgelegt werden. Neben den in dieser Leitlinie aufgeführten Schritten zur Qualitätssicherung können weitere Maßnahmen zur Sicherung und ständigen Verbesserung der erbrachten Leistungen durchgeführt werden.
Für schriftliche Antworten wird das sogenannte „Vier-Augen-Prinzip“ empfohlen, nach dem jede Antwort vor Weitergabe an den Fragesteller durch einen erfahrenen Apotheker inhaltlich und formal gegengelesen wird. Bei mündlichen (Vorab-)Informationen kann dies durch mündliche Rücksprache erfolgen.
Weitere Maßnahmen können sein [5, 27, 52, 56]:
- Exemplarische Prüfung einzelner Anfragen
- Teilnahme an Ringversuchen
- Teilnahme an überregionalen Qualitätszirkeln
- Evaluation/Kundenbefragung
Die Durchführung einer Evaluation/Kundenbefragung dient der Ermittlung der Zufriedenheit des Fragestellers mit dem Arzneimittelinformationsservice und zur Ermittlung von Optimierungsbedarf. Es empfiehlt sich die Verwendung eines Fragebogens, der per E-Mail, Fax oder Brief zurückgesandt oder online ausgefüllt werden kann. In Anlage 2 ist eine Beispielvorlage dargestellt. Erfolgt in Ausnahmefällen die Antwort in mündlicher Form, sollte durch gezielte Nachfrage die Zufriedenheit des Fragestellers bezüglich Art und Umfang der Auskunft ermittelt werden. Das Ergebnis ist auf einem Fragebogen zu dokumentieren. Der Fragebogen sollte zur Abschätzung der Kundenzufriedenheit mindestens beinhalten:
- Qualität der Antwort
- Angemessener Umfang der Antwort
- Termingerechte Beantwortung
- Umsetzbarkeit in die Praxis
Im Falle von Negativbeurteilungen sollte ein Maßnahmenplan die weitere Vorgehensweise festlegen.
Die ADKA bietet einen jährlichen Ringversuch Arzneimittelinformation an, bei dem unter simulierten Praxisbedingungen eine Testanfrage beantwortet wird. Die Teilnahme wird mit einem Zertifikat bestätigt. Die Teilnahme der Krankenhausapotheken wird empfohlen.
Für das Arbeitsgebiet Arzneimittelinformation können Qualitätsindikatoren festgelegt werden. Anlage 3 erläutert Hintergründe zur Festlegung und bietet Vorschläge.
V Verabschiedung
Die Leitlinie wurde durch den Vorstand der ADKA am 15.09.2021 verabschiedet.
Literatur
1. Abate MA, Blommel ML (Hrsg.). Drug information and literature evaluation. Pharmaceutical Press London, 2013.
2. Altwairgi AK, et al. Discordance between conclusions stated in the abstract and conclusions in the article: analysis of published randomized controlled trials of systemic therapy in lung cancer. J Clin Oncol 2012;30:3552–7.
3. Apothekenbetriebsordnung (ApBetrO). Zuletzt geändert 13.1.2020. https://www.gesetze-im-internet.de/apobetro_1987/ApBetrO.pdf
4. Arguello B et al. Assessing the information in the Summaries of Product Characteristics for the use of medicines in pregnancy and lactation. Br J Clin Pharmacol 2014;79:537–44.
5. Beaird SL, et al. Assessing the accuracy of drug information responses from drug information centres. Ann Pharmacother 1994;28:707–11.
6. Bergk V, et al. Information deficits in the summary of product characteristics preclude an optimal management of drug interactions: a comparison with evidence from the literature. Eur J Clin Pharmacol 2005;61:327–35.
7. Bond CA, et al. Clinical pharmacy services and hospital mortality rates. Pharmacotherapy 1999;19:556–64.
8. Bond CA, et al. Clinical pharmacy services, pharmacy staffing, and the total cost of care in United States hospitals. Pharmacotherapy 2000;20:609–21.
9. Bramer WM et al. The comparative recall of Google Scholar versus PubMed in identical searches for biomedical systematic reviews: a review of searches used in systematic reviews. Systematic Reviews 2013;2:115.
10. Bramer WM et al. Optimal database combination for literature searches in systematic reviews: a prospective exploratory study. Systematic Reviews 2017;6:245.
11. Bramley DM, et al. The impact of medicines information enquiry answering on patient care and outcomes. Int J Pharm Pract. Published online Jan 28, 2013; doi: 10.1111/jpp.12018
12. Brown JN. Cost savings associated with a dedicated drug information service in an academic medical centre. Hosp Pharm 2011;46:680–4.
13. Bundesapothekerkammer. Arzneimittelinformation in der Apotheke und in Informationsstellen der Apothekerschaft. Leitlinie der Bundesapothekerkammer zur Qualitätssicherung. Stand 08.05.2018.
14. Bundes-Apothekerordnung. Zuletzt geändert 15.8.2019.
15. Calis KA et al. Quality of pharmacotherapy consultations provided by drug information centres in the United States. Pharmacotherapy 2000;20:830–6.
16. Datenschutz-Grundverordnung (DSGVO) 2016/679.
17. DIN EN 15224–2017. Bereichsspezifische Norm des Qualitätsmanagements für Organisationen der Gesundheitsversorgung.
18. Fischer JM. Modification to the systematic approach to answering drug information requests. Am J Hosp Pharm 1980;37:470–6.
19. Gemeinsamer Bundesausschuss (G-BA). Regelungen zum Qualitätsbericht der Krankenhäuser, Qb-R. Stand 17.3.2021.
20. Gesetz über das Apothekenwesen (Apothekengesetz). Zuletzt geändert 9.8.2019. https://www.gesetze-im-internet.de/apog/ApoG.pdf .
21. Ghaibi S, et al. ASHP guidelines on the pharmacist’s role in providing drug information. Am J Health-Syst Pharm. 2015; 72:573–7.
22. Grizzle AJ, et al. Identifying Common Methods Used by Drug Interaction Experts for Finding Evidence About Potential Drug-Drug Interactions: Web-Based Survey. J Med Internet Res 2019;21 doi: 10.2196/11182.
23. Grossmann S, et al. Health and medication information resources on the world wide web. J Pharm Pract 2013;26:85–94.
24. Haddaway NR, et al. The role of Google Scholar in evidence reviews and is applicability to grey literature searching. PLOS One 2015;10 e0138237. doi: 10.1371/journal.pone.0138237
25. Hands D, et al. A systematic review of the clinical and economic impact of drug information services on patient outcome. Pharm World Sci 2002;24:132–8.
26. International Pharmaceutical Federation (FIP) (2005) Requirements for Drug Information Centre. https://www.cff.org.br/userfiles/file/cebrim/RequirementsforDrugInformationCentres%202005%20final.pdf
27. Johnson N, et al. A quality assurance audit of a drug information service. Can J Hosp Pharm 1989;42:57–61.
28. Kinky DE, et al. Economic impact of a drug information service. Ann Pharmacother 1999;33:11–6.
29. Leitlinie für ADKA-Leitlinien – Leitlinie zur Qualitätssicherung. Expertengremium: Dr. Werner Grieb, Heidenheim; Dr. Manfred Haber, Homburg/Saar; Michael Höckel, Kassel; Dr. Dirk Keiner, Suhl; Dr. Elfriede Nusser-Rothermundt, Stuttgart; Sabine Steinbach MSc, Trier (Vorsitz); Almut Weygand, Hannover; in Abstimmung mit den ADKA-Landesverbänden. Krankenhauspharmazie 2013;34:553–4.
30. Malone PM, Kier KL, Stanovich JE. Drug information: a guide for pharmacists. 4th edition. New York: Mc Graw-Hill, 2012.
31. McConachie SM, et al. Adverse drug reactions in drug information databases: does presentation affect interpretation. J Md Libr Assoc 2020;108 DOI: dx.doi.org/10.5195/jmla.2020.748
32. Mountford CM, et al. Quality and usability of common drug information databases. Can J Hosp Pharm 2010;63:130–7.
33. Nathan JP. Drug information – the systematic approach: continuing education article. J Pharm Pract 2013;26:78–84.
34. Patel RI, et al. Evaluation of resources for analyzing drug interactions. J Med Libr Assoc 2016; 104:290–5.
35. Pauly A, et al. Evaluation of eight drug interaction databases commonly used in the German healthcare system. Eur J Hosp Pharm 2014;22:165–70.
36. Paterno MD, et al. Tiering drug-drug interaction alerts by severity increases compliance rates. J Am Med Inform Assoc 2009;16:40–6.
37. Pfistermeier B, et al. Different indications, warnings and precautions, and contraindications for the same drug – an international comparison of prescribing information for commonly used psychiatric drugs. Pharmacoepidemiol Drug Saf 2013;22:329–33.
38. Pitkin RM, et al. Accuracy of data in abstracts of published research articles. JAMA 1999;281:1110–1.
39. Pompe SV, et al. Quality of information on male fertility in the summary of product characteristics – cause for concern. Eur J Hosp Pharm 2015;22(Suppl 1):A86–7.
40. Präsidium und Vorstand der ADKA (Bundesverband deutscher Krankenhausapotheker) e. V., ADKA-Zielepapier 2014. Krankenhausapotheker schaffen den bestmöglichen Nutzen der Arzneimitteltherapie für die Patienten. Krankenhauspharmazie 2014;35:45–53.
41. Rambaran K, et al. The Gap in Electronic Drug Information Resources: A Systematic Review. Cureus 2018;10: e2860. DOI 10.7759/cureus.2860
42. Reis-Pardal J, et al. Comparing cytochrome P450 pharmacogenetic information available on United States drug labels and European Union Summaries of Product Characteristics. Pharmacogenomics J 2017;17:488–93.
43. Reppe LA, et al. Factors associated with time consumption when answering drug-related queries to Scandinavian drug information centres: a multi-centre study. Eur J Clin Pharmacol 2014;70:1395–1401.
44. Reppe LA, et al. Relationship Between Time Consumption and Quality of Responses to Drug-related Queries: A Study From Seven Drug Information Centers in Scandinavia. Clin Ther 2016;38:1738–49.
45. Reppe LA, et al. Quality of structure and language elements of written responses given by seven Scandinavian drug information centers. Eur J Clin Pharmacol 2017;73:623–31.
46. Rutter J, et al. Impact of pharmacy medicine information service advice on clinician and patient outcomes: an overview. Health Inform Libr J 2019;26:299–317.
47. San Miguel MT, et al. Food-drug interactions in the summary of product characteristics of proprietary medicinal products. Eur J Clin Pharmacol 2005;61:77–83.
48. Seo Y, et al. Elements of Regulatory Dissonance: Examining FDA and EMA Product Labeling of New Vaccines (2006–2018). Vaccine 2020;38:7485–9.
49. Schjott J, et al. Use of References in Responses from Scandinavian Drug Information Centres. Medicines 2018;66 doi: 10.3390/medicines5030066
50. Schjott J, et al. Analysis of consensus among drug interaction databases with regard to combinations of psychotropics. Basic Clin Pharmacol Toxicol 2020126:126–32.
51. Schuhmacher C, et al. Der „Quick Question Guide“. Krankenhauspharmazie 2011;32–7.
52. Smith CJ, et al. External quality assurance committee for drug information services. Am J Hosp Pharm 1990;47:787–91.
53. Society of Hospital Pharmacists of Australia. Australian Medicines Information Procedure Manual. February 2017.
54. Strafgesetzbuch (StGB) § 203 Verletzung von Privatgeheimnissen.
55. Strobach D, et al. Assessing the quality of drug information provided by hospital pharmacies using a fictitious enquiry and simulated real-life conditions. Eur J Hosp Pharm 2020 doi: 10.1136/ejhpharm-2020-002409
56. Tierney M, et al. A peer review quality assurance program in drug information. Can J Hosp Pharm 1991;44:31–4.
57. UKMI Medicines information enquiry answering guidelines. Version 1.1 March 2021. https://www.sps.nhs.uk/articles/ukmi-enquiry-answering/
58. UKMI Quality and risk management group. Internet searching for medicines information staff. Version 2.0 March 2020. https://www.sps.nhs.uk/wp-content/uploads/2016/10/Internet-Searching-2.0.pdf
59. Vidal L, et al. Systematic comparison of four sources of drug information regarding adjustment of dose for renal function. BMJ 2005;331:263.
60. Wall AJB, et al. Variability in the quality of overdose advice in summary of product characteristics (SPC) documents: gut decontamination recommendations for CNS drugs. Br J Clin Pharmacol 2008;67:83–7.
61. Watanabe AS, et al. Systematic approach to drug information requests. Am J Hosp Pharm 1975;32:1282–5.
62. Weersink RA, et al. Evaluation of information in summaries of product characteristics (SmPCs) on the use of medicine in patients with hepatic impairment. Front Pharmacol 2019;10 doi: 10.3389/fphar.2019.01031
63. Working Group GPGI. Good practice guideline for health information. ZEFQ 2016;110–11:e1–8.
64. Wright SG, et al. A review of the three types of biomedical literature and the systematic approach to answer a drug information request. J Pharm Pract 1998;11:148–62.
65. Ziegler A, et al. Comprehension of the description of side effects in drug information leaflets. Dtsch Ärzteblatt Int 2013;110:669–73.
66. European Association of Hospital Pharmacy. The European Statements of Hospital Pharmacy. https://statements.eahp.eu/statements/european-statements-hospital-pharmacy (Zugriff am 18.07.2021).
67. ÄZQ – Ärztliches Zentrum für Qualität in der Medizin. Qualitätsindikatoren – Manual für Autoren. äzq Schriftenreihe Band 362009. ISBN 978-3940218-551
68. Joint Commission on Accreditation of Healthcare Organizations (JCAHO). Guide to Quality Assurance. Chicago: JCAHO; 1998.
Anlage 1: Wichtige Themengebiete der Arzneimittelinformation und Beispiele für Recherchequellen
Als Recherchequellen sind exemplarische Beispiele aufgeführt, es handelt sich überwiegend um Tertiärliteratur. Wie im Text beschrieben, ist bei nicht ausreichendem Ergebnis in Quellen der Sekundär- und Primärliteratur weiterzusuchen.
Allgemeine Quellen eignen sich zum Nachschlagen verschiedenster Informationen und können zum Einstieg für fast alle Arten von Anfragen verwendet werden.
Keine Quelle ist vollkommen und daher sollte niemals eine Quelle allein zur Recherche verwendet werden. Die Information sollte in mindestens einer weiteren Quelle verifiziert werden.
Bei zugelassenen Arzneimitteln soll unbedingt die Fachinformation konsultiert werden um zu prüfen, ob die herauszugebende Information sich im Rahmen der Zulassung bewegt oder ob ein Off-label-Einsatz empfohlen wird.
Die Liste dient lediglich zur Orientierung und wird regelmäßig aktualisiert. Die aktuelle Form wird auf der Internetseite des Ausschusses Arzneimittelinformation der ADKA hinterlegt. Trotzdem kann es in Einzelfällen vorkommen, dass ein Link veraltet oder eine Quelle nicht mehr verfügbar ist. Die Quellen sind gekennzeichnet als kostenfrei oder kostenpflichtig.
Tab. 1. Wichtige Themengebiete der Arzneimittelinformation und Beispiele für Recherchequellen
|
Bezeichnung |
Herausgeber |
Zugang / Bemerkungen |
Kosten |
|
Allgemeine Informationsquellen (z. B. für die Recherche nach Dosierungen, Zulassungen, Nebenwirkungen, Pharmakologie und Pharmakokinetik) |
|||
|
Fachinformation |
Fachinfoservice |
nicht alle Fachinformationen sind hier verfügbar, alternativ auf der Seite des Herstellers bzw. bei der EMA suchen |
kostenfrei |
|
ABDA Datenbank |
Avoxa Mediengruppe Deutscher Apotheker GmbH |
Diverse Zugangsmöglichkeiten |
kostenpflichtig |
|
UpToDate |
Wolters Kluwer Health |
kostenpflichtig |
|
|
British National Formulary (BNF) |
British Medical Association und Royal Pharmaceutical Society |
Medicines Complete Print |
kostenpflichtig |
|
European Medicines Agency |
EMA |
kostenfrei |
|
|
Drugsite Trust |
Fachinformation von US-Arzneimitteln |
kostenfrei |
|
|
Pubmed/Medline |
National Library of Medicine |
ggf. weiterer Zugang via Universitäts-Bibliothek mit anderer Suchoberfläche |
kostenfrei |
|
Specialist Pharmacy Services |
SPS / NHS England |
vielfältige Informationsquelle, größtenteils |
kostenfrei |
|
AHFS Drug Information |
American Society of Health- |
Medicines Complete |
kostenpflichtig |
|
Martindale. The Complete Drug Reference |
Pharmaceutical Press |
Medicines Complete |
kostenpflichtig |
|
Drugdex |
IBM Watson Health |
kostenpflichtig |
|
|
Arzneimitteltherapie- und auswahl |
|||
|
Therapieleitlinien |
Medizinische Fachgesellschaften |
www.awmf.org (D) Seiten der europäischen Fachgesellschaften (EU) |
kostenfrei |
|
Merck Manual of Diagnosis and Treatment |
Merck & Co. |
kostenfrei |
|
|
Sandford Guide |
Antimicrobial Therapy Inc. |
kostenpflichtig |
|
|
Johns Hopkins Guide ABX |
Unbound Medicine, USA |
freie Inhalte und kostenpflichtige |
kostenfrei/ |
|
Schmoll: Kompendium der |
Springer-Verlag |
Buch, eBook |
kostenpflichtig |
|
Berger, Mertelsmann: Das Rote Buch |
Verlag ECO Med |
Buch |
kostenpflichtig |
|
Engelhardt et al.: Das Blaue Buch. Chemotherapie- |
Springer-Verlag |
www.springer.com/de/book/9783662514207 Open-Access-Buch online |
kostenfrei |
|
Cancer Treatments online |
Cancer Institute NSW, Australia |
kostenfrei |
|
|
Unerwünschte Arzneimittelwirkungen |
|||
|
Meyler’s Side Effects of Drugs |
Elsevier |
www.sciencedirect.com/referencework/9780444537164/meylers-side-effects-of-drugs |
kostenpflichtig |
|
G6PD |
Assiociazione Italiana Favismo |
kostenfrei |
|
|
Europäische Datenbank gemeldeter Verdachtsfälle |
EMA |
kostenfrei |
|
|
VigiBase (globale Datenbank gemeldeter Verdachtsfälle) |
WHO / Uppsala Monitoring Centre |
kostenfrei |
|
|
CredibleMeds |
AZCERT |
Arzneimittel und QT-Verlängerung |
kostenfrei |
|
Arzneimittelinteraktionen |
|||
|
Stockley’s Drug Interactions |
Pharmaceutical Press |
Medicines Complete |
kostenpflichtig |
|
MediQ |
Psychiatrische Dienste |
kostenpflichtig |
|
|
Youscript, Pharmacokinetic Drug Interactions |
Youscript, USA |
kostenpflichtig |
|
|
LexiInteract |
Lexicomp |
z. B. über www.uptodate.com |
kostenpflichtig |
|
HIV Drug Interactions |
University of Liverpool |
kostenfrei |
|
|
Hepatitis Drug Interactions |
University of Liverpool |
kostenfrei |
|
|
Cancer Drug Interactions |
Rabound University Medical Centre NL University of Liverpool |
kostenfrei |
|
|
Drugs.com Interaction checker |
Cerner Multum |
kostenfrei |
|
|
Medscape Drug Interaction checker |
Medscape |
kostenfrei |
|
|
DDI Predictor |
Genophar II Working Group, ISPB Faculté de Pharmacie de Lyon |
inklusive Abschätzung des metabolischen Einflusses von Leberzirrhose |
kostenfrei |
|
Cytochrome P450 Drug |
Indiana University |
kostenfrei |
|
|
Schwangerschaft und Stillzeit |
|||
|
Briggs et al.: Drugs in pregnancy and lactation |
Wolters Kluwer Health |
Print (mit Code für online-Zugang) |
kostenpflichtig |
|
Schaefer et al.: Arzneimittel in Schwangerschaft und Stillzeit |
Elsevier |
|
kostenpflichtig |
|
Hale: Medication and mothers milk |
Springer Corporation |
|
kostenpflichtig |
|
Embryotox |
Charité Universitätsmedizin |
Arzneimittelmonographien (Schwangerschaft und Stillzeit) und indikationsbasierte Therapieempfehlungen (nur Schwangerschaft) |
kostenfrei |
|
UKTIS |
UK Teratology Information |
kostenpflichtig |
|
|
LactMed |
National Library of Medicine |
www.ncbi.nlm.nih.gov/books/NBK501922/ |
kostenfrei |
|
e-Lactancia |
APILAM (ES) |
kostenfrei |
|
|
Reprotox |
UK Ulm |
Anfrage über Online-Formular |
kostenfrei |
|
Pädiatrie |
|||
|
Lexicomp Pediatric & Neonatal Dosage Handbook |
Wolters Kluwer |
|
kostenpflichtig |
|
British National Formulary (BNF) for children |
British Medical Association und Royal Pharmaceutical Society |
www.bnf.org (App für Android und iOS) Medicines Complete Print halbjährlich |
kostenpflichtig |
|
Neonatal Drug Formulary |
Children and Young People’s Service MKN, NHS Scotland |
kostenfrei |
|
|
Neonatal Formulary: Drug Use in Pregnancy and the First Year of Life |
Oxford Medicine Online |
www.oxfordmedicine.com/view/10.1093/med/9780198840787.001.0001/med-9780198840787-appendix-3 |
kostenfrei |
|
Kinderformularium |
Universitätsklinikum Erlangen |
kostenfrei |
|
|
Seltene Erkrankungen |
|||
|
BIMDG Formulary |
British Inherited Metabolic |
kostenfrei |
|
|
NORD |
National Organization for Rare Diseases |
kostenfrei |
|
|
Orphanet |
Institut national de la santé et de la recherche médicale (FR) |
Information zu seltenen Erkrankungen und angewandten Arzneimitteln |
kostenfrei |
|
Drugs in Porphyria Safe List |
Welsh Medicines Information Centre |
www.wmic.wales.nhs.uk/specialist-services/drugs-in-porphyria |
kostenfrei |
|
Palliativmedizin |
|||
|
Palliative Care Guidelines |
Kooperation von UK-Palliativmedizinern |
kostenfrei |
|
|
Scottish Palliative Care |
NHS Scotland |
kostenfrei |
|
|
Bausewein, Remi: Arzneimitteltherapie in der Palliativmedizin |
Elsevier |
Buch |
kostenpflichtig |
|
Arzneimittel bei Lebererkrankungen |
|||
|
North-Lewis, P. Drugs and the liver |
Pharmaceutical Press |
Print (2008) |
kostenpflichtig |
|
LiverTox |
National Library of Medicines |
www.ncbi.nlm.nih.gov/books/NBK547852/ |
kostenfrei |
|
Geneesmiddelen bij levercirrose |
Stichting Health Base |
www.geneesmiddelenbijlevercirrose.nl Niederländisch, „Informatie voor zorgverleners“ wählen Ausgewählte Monographien auf Englisch |
kostenfrei |
|
Arzneimittel bei Niereninsuffizienz und Nierenersatzverfahren |
|||
|
Ashley, C. The Renal Drug Handbook |
Taylor & Francis Ltd |
Print mit Zugangscode zum E-Book auch als Online-Datenbank |
kostenpflichtig |
|
Dosing |
Dosing GmbH, Heidelberg |
kostenfrei |
|
|
CADDy |
Otto Frey Judith Preisenberger |
kostenfrei |
|
|
Komplementäre Arzneimittel |
|||
|
Memorial Sloan-Kettering Cancer Center |
Integrative Medicine Service |
www.mskcc.org/cancer-care/diagnosis-treatment/symptom-management/integrative-medicine/herbs „Search About Herbs“ wählen |
kostenfrei |
|
Natural Medicines Database |
Therapeutic Research Centre |
kostenpflichtig |
|
|
Stockley’s Herbal Medicines |
Pharmaceutical Press |
Medicines Complete |
kostenpflichtig |
|
National Center for Complementary and Integrative Health |
National Library of Medicines, USA |
kostenfrei |
|
|
Applikation, Kompatibilität und Stabilität |
|||
|
Trissel: Handbook on injectable drugs |
ASHP |
Medicines Complete |
kostenpflichtig |
|
PÄD i. v. |
Online über ADKA AM-Info- |
ADKA AM-Info-Datenbank |
kostenpflichtig |
|
King Guide to Parenteral Admixtures |
King Guide Publications |
|
kostenpflichtig |
|
Handbook of drug administration via enteral feeding tubes |
Pharmaceutical Press |
Medicines Complete |
kostenpflichtig |
|
Stabilis |
Infostab |
kostenfrei |
|
|
KIK-Kompatibilität im |
B.Braun |
www.bbraun.de/de/produkte-und-therapien/infusionstherapie/kompatibilitaeten.html |
kostenfrei |
|
Pharmatrix |
Andreas Pfaff, Universitätsklinikum Tübingen |
u. a. Sondentabelle – CAVE: wird zur Zeit nicht mehr aktualisiert |
kostenfrei |
|
Ernährung |
|||
|
Deutsche Gesellschaft für Ernährung |
DGE |
kostenfrei |
|
|
Deutsche Gesellschaft für Ernährungsmedizin |
DGEM |
kostenfrei |
|
|
European Society for parenteral and enteral nutrition |
ESPEN |
kostenfrei |
|
|
Toxikologie |
|||
|
Poisindex |
Wolters Kluwer |
kostenpflichtig |
|
|
Giftinformationszentren |
Träger sind Länder |
Liste unter www.bvl.bund.de |
kostenfrei |
|
PubChem |
National Library of Medicine |
Umfangreiche Monographien, u. a. Toxicity |
kostenfrei |
|
Toxbase |
UK National Poisons Information Centre |
Online, App für Android und iOS |
kostenpflichtig |
Letzte Überprüfung der Hperlinks am 15.09.2021
Anlage 2: Beispiel eines Feedback-Fragebogens
Sehr geehrte/r (…),
Sie haben uns am xx.xx.xxxx mit Ihrer Anfrage bezüglich (…) kontaktiert. Damit wir den Nutzen der Beantwortung Ihrer Anfragen für Sie bzw. Ihren Patienten weiter optimieren können, würden wir uns sehr freuen, wenn Sie uns kurz folgende Fragen beantworten und den Fragebogen per Fax (…) / Post (…) / E-Mail (…) an uns zurücksenden.
Oder: …, wenn Sie den folgenden Online-Fragebogen zeitnah ausfüllen.
Herzlichen Dank!
Mit freundlichen, kollegialen Grüßen
Ihre [Krankenhausapotheke]
1. Wie erhielten Sie die Beratung?
- Telefon
- Fax
- Brief
- Sonstiges:
2. Wie beurteilen Sie die fachliche Qualität?
- sehr gut
- gut
- befriedigend
- ausreichend
- ungenügend
3. Wie beurteilen Sie die Verständlichkeit?
- sehr gut
- gut
- befriedigend
- ausreichend
- ungenügend
4. Wurde Ihr Anfrage innerhalb des vereinbarten Zeitrahmens beantwortet?
- ja
- nein
- nein, aber ich wurde über die Verzögerung informiert
5. Wurde Ihnen Informationsmaterial zur Verfügung gestellt?
- ja, und zwar
- Originalpublikationen (Abstract)
- Adressen/Linklisten
- Referate
- Patienteninformationen
- Sonstige ____________________
- nein
6. Waren Sie mit Qualität und Umfang des Informationsmaterials zufrieden?
- sehr gut
- gut
- befriedigend
- ausreichend
- ungenügend
7. Konnte durch die Beratung eine konkrete Verbesserung der Therapie des Patienten erreicht werden?
- nein
- noch nicht zu beurteilen
- ja, und zwar:
8. Haben Sie Anregungen, Wünsche oder Kritik an uns?
__________________________________________________________________________________________
_______________________________________________________________________________________________________________________________________
Anlage 3: Qualitätsindikatoren
Qualitätsindikatoren sind qualitätsbezogene Kennzahlen, deren Ausprägung eine Unterscheidung zwischen guter und schlechter Qualität bezogen auf Strukturen, Prozesse und/oder Ergebnisse der Versorgung ermöglichen soll. Sie sollen nach bestmöglicher verfügbarer Evidenz erstellt werden. Qualitätsindikatoren dienen der Evaluation, dem Monitoring und zur Erkennung von notwendigen Handlungsfeldern (Alarmfunktion) [67]. Zur Erstellung von Qualitätsindikatoren können Kriterien zur Messung und Bewertung der Versorgung herangezogen werden, wie sie z. B. von der Joint Commission on Accreditation of Healthcare Organizations (JCAHO) vorgeschlagen wurden [67, 68].
In der Recherche in der internationalen Literatur konnten keine definierten Qualitätsindikatoren für das Aufgabengebiet Arzneimittelinformation aus der Krankenhausapotheke ermittelt werden. Die nachfolgend in der Tabelle genannten Qualitätsindikatoren orientieren sich an ausgewählten Kriterien der JCAHO mit dem Fokus auf die Arzneimittelinformation. Die genannten Qualitätsindikatoren sind als Beispiele zu verstehen, die an die Gegebenheiten der jeweiligen Krankenhausapotheke anzupassen sind.
Tab. 2. Qualitätsindikatoren
|
Qualitätskriterium der JCAHO |
Abgeleitete Frage für die |
Möglicher Qualitätsindikator |
Messung |
|
Zugänglichkeit der Versorgung |
Einfache Zugänglichkeit von Auskünften der AM-Info für das medizinische Personal des Krankenhauses, z. B. telefonisch, E-Mail, Fax? Für den Patienten? |
AM-Info ist zu den üblichen Öffnungszeiten der Apotheke durchgängig zu erreichen. |
% Erreichbarkeit |
|
Angemessenheit der Versorgung; Stetigkeit der Versorgung |
Stehen qualifizierte Ansprechpartner zeitlich ausreichend zur Verfügung? |
Es besteht eine eigene Abteilung AM-Info. Es ist durchgängig ein Apotheker mit Erfahrung in der AM-Info und auf Station erreichbar. Es ist durchgängig ein Apotheker mit Erfahrung in der AM-Info erreichbar. Es ist durchgängig ein Apotheker erreichbar. |
% Erreichbarkeit |
|
Werden Evidenzaspekte für die Recherche beachtet? |
Retrospektive Evaluation: mindestens zwei unabhängige Quellen verwendet? |
% erfüllt |
|
|
Erfolgen Maßnahmen der Qualitätskontrolle? |
Findet Vier-Augen-Prinzip statt? Enthalten Antworten ein Fazit/Empfehlung? Wird die Literatur nachvollziehbar angegeben? Jährliche Teilnahme am Ringversuch AM-Info? |
% erfüllt |
|
|
Wirksamkeit der Versorgungspraxis |
Ist die AM-Info im Haus bekannt und wird von Ärzten, Pflege, anderen genutzt? |
Anzahl Anfragen im Jahr nach Gruppen |
Anzahl n bezogen auf 100 Betten |
|
Werden die (tatsächlichen) Fragen beantwortet? |
Abfrage in Feedbackbögen: ja/nein |
% Frage beantwortet |
|
|
Erreichen die Antworten den Fragesteller sicher? |
Abfrage in Feedbackbögen: ja/nein |
% erhalten |
|
|
AM-Info als sinnvoll zur Erhöhung der Verordnungssicherheit bzw. AMTS bewertet? |
Abfrage in Feedbackbögen: ja/nein |
% ja |
|
|
Wirtschaftlichkeit der Versorgung |
Werden durch AM-Info Einsparungen bei Arzneimitteln oder in der Behandlung erzielt? |
Kostenerfassung Einsparung Arzneimittel. Erfassung Kosten von z. B. vermiedenen Untersuchungen, kürzerem Krankenhausaufenthalt. |
Euro pro Jahr abzüglich Kosten für AM-Info (Personal, Datenbanken, weitere Ausstattung) |
|
Patientenorientiertheit der Versorgung |
Werden patientenindividuelle Aspekte der Fragen ausreichend berücksichtigt? |
Abfrage in Feedbackbögen: war die Frage auf den Patientenfall angepasst ja/nein. Nachträgliche Prüfung anhand der Patientendokumentation durch Apotheker: wurden alle patientenrelevanten Faktoren beachtet? |
% ja |
|
Rechtzeitigkeit der Versorgung |
Werden Fragen im abgesprochenen Zeitfenster beantwortet oder Rückmeldung gegeben? |
Abfrage in Feedbackbögen: ja/nein |
% ja |
AM-Info = Arzneimittelinformationsservice der Krankenhausapotheke
*Aus Gründen der einfacheren Lesbarkeit wird in der Krankenhauspharmazie auf eine geschlechterspezifische Differenzierung verzichtet. Entsprechende Begriffe sind im Sinne der Gleichbehandlung generell für alle Geschlechter zu verstehen.
Für die Expertengruppe: Claudia Mildner (Vorsitzende), Apotheke der Universitätsmedizin der Johannes Gutenberg-Universität Mainz, Langenbeckstr. 1, 55131 Mainz, E-Mail: claudia.mildner@unimedizin-mainz.de
Krankenhauspharmazie 2021; 42(11):452-465
